1 . 氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH和H2O在某Cu/Zn-Al催化剂存在下生产H2, H2与Mg在一定条件下制得储氢物质X。
回答问题: .
(1) Al在周期表中的位置______________ 。基态Zn的价层电子排布式___________ 。
(2)水分了中氧原子的杂化轨道类型_______________ 。
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有_________ 种键能数据。CH3OH可以与水以任意比例互溶的原因是___________________ 。
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为______________ , X的储氢质量分数是______________ ,c= ___________ pm (列出计算式即可)。
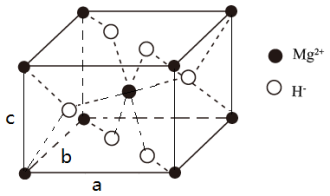
回答问题: .
(1) Al在周期表中的位置
(2)水分了中氧原子的杂化轨道类型
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为

您最近一年使用:0次
2020-10-12更新
|
4052次组卷
|
5卷引用:2020年海南省高考化学试卷(新高考)
2020年海南省高考化学试卷(新高考)(已下线)难点10 物质结构与性质综合题-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)2020年海南卷化学高考真题变式题15-19北京市第一六一中学2021-2022学年高三上学期期中考试化学试题
名校
2 . 合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为___________ ,占据最高能级电子的电子云轮廓图为___________ 形。
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为___________ 。
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是___________ 。
②比较Mg、Ca第一电离能的大小:___________ 。O的第一电离能小于N,原因是___________ 。
③下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
结合数据说明Mg的常见化合价为+2价的原因:___________ 。
(3)我国科研人员研制出了“Fe—LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为___________ ,铁在元素周期表中的位置___________ 。
②比较Li+与H-的半径大小关系:r(Li+)___________ r(H-)(填“>”或“<”)。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
②比较Mg、Ca第一电离能的大小:
③下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
| 元素 | Na | Mg | Al |
| 电离能(kJ/mol) | 496 | 738 | 578 |
| 4562 | 1451 | 1817 | |
| 6912 | 7733 | 2745 | |
| 9543 | 10540 | 11575 |
(3)我国科研人员研制出了“Fe—LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为
②比较Li+与H-的半径大小关系:r(Li+)
您最近一年使用:0次
2022-03-15更新
|
800次组卷
|
4卷引用:北京师范大学附属中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
3 . 根据所学知识回答问题:
(1)写出表示含有8个质子,10个中子的原子的结构示意图:___________ 。
(2)最外层电子数为次外层电子数 的原子
的原子___________ 或___________ ;(填元素符号)
(3)根据下列微粒回答问题: 、
、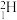 、
、 、
、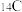 、
、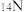 、
、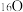 、
、 、
、 。
。
①以上8种微粒共有___________ 种核素,共___________ 种元素。
②互为同位素的是___________ 。
③中子数相等的是___________ 。
(4)相同物质的量的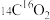 与
与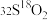 的质量之比为
的质量之比为___________ ;电子数之比为___________ 。
(1)写出表示含有8个质子,10个中子的原子的结构示意图:
(2)最外层电子数为次外层电子数
 的原子
的原子(3)根据下列微粒回答问题:
 、
、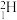 、
、 、
、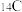 、
、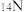 、
、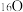 、
、 、
、 。
。①以上8种微粒共有
②互为同位素的是
③中子数相等的是
(4)相同物质的量的
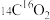 与
与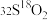 的质量之比为
的质量之比为
您最近一年使用:0次
4 . 回答下列问题:
(1)已知短周期元素A、B,A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为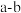 ,L层电子数为
,L层电子数为 ,则A为
,则A为___________ (填元素符号,下同),B为___________ 。
(2)已知X元素原子的L层比Y元素原子的L层少3个电子,Y元素原子的核外电子总数比X元素原子多5,则X、Y分别为___________ 、___________ 。
(1)已知短周期元素A、B,A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为
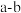 ,L层电子数为
,L层电子数为 ,则A为
,则A为(2)已知X元素原子的L层比Y元素原子的L层少3个电子,Y元素原子的核外电子总数比X元素原子多5,则X、Y分别为
您最近一年使用:0次
名校
5 . (1)下列状态的镁中,电离最外层一个电子所需能量最大的是_____________ .
A.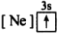 B.
B.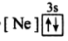 C.
C.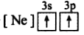 D.
D.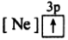
(2) 成为阳离子时首先失去
成为阳离子时首先失去____________ 轨道电子, 的价层电子排布式为
的价层电子排布式为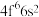 ,
,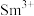 价层电子排布式为
价层电子排布式为____________ .比较离子半径:
____________ (填“大于”“小于”或“等于”) .
.
(3)在周期表中,与 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是___________ ,该元素基态原子核外 层电子的自旋
层电子的自旋___________ (填“相同”或“相反”). 中,电负性最高的元素是
中,电负性最高的元素是___________ .
(4) 基态核外电子排布式为
基态核外电子排布式为___________ .
A.
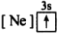 B.
B.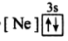 C.
C. D.
D.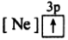
(2)
 成为阳离子时首先失去
成为阳离子时首先失去 的价层电子排布式为
的价层电子排布式为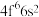 ,
,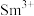 价层电子排布式为
价层电子排布式为
 .
.(3)在周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是 层电子的自旋
层电子的自旋 中,电负性最高的元素是
中,电负性最高的元素是(4)
 基态核外电子排布式为
基态核外电子排布式为
您最近一年使用:0次
2021-02-01更新
|
1071次组卷
|
4卷引用:鲁科版2019选择性必修2第1章 原子结构与元素性质 第1章学科素养提升
解题方法
6 . 按要求填空:
(1)基态Si原子中,电子占据的能量最高的电子层符号为_______ ,该电子层具有的原子轨道数为_______ ,具有的电子数为_______
(2)基态N原子中,核外电子占据_______ 个电子层,_______ 个原子轨道,共有_______ 种运动状态;电子占据的能量最高的原子轨道的形状为_______ 。
(1)基态Si原子中,电子占据的能量最高的电子层符号为
(2)基态N原子中,核外电子占据
您最近一年使用:0次
2022-08-22更新
|
240次组卷
|
2卷引用:专题2 原子结构与元素性质 第一单元 原子核外电子的运动 第1课时 人类对原子结构的认识 原子核外电子的运动特征
22-23高一上·全国·课时练习
7 . 电子分层排布
(1)能量最低原理
核外电子总是优先排布在_______ 的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
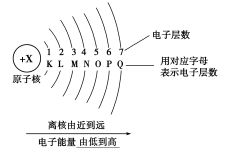
(2)电子层最多容纳的电子数
①第n层最多容纳_______ 个电子。如K、L、M、N层最多容纳电子数分别为_______ 。
②最外层电子数目最多不能超过_______ 个(K层为最外层时不能超过_______ 个)。
③次外层最多能容纳的电子数不超过_______ 个。
(1)能量最低原理
核外电子总是优先排布在

(2)电子层最多容纳的电子数
①第n层最多容纳
②最外层电子数目最多不能超过
③次外层最多能容纳的电子数不超过
您最近一年使用:0次
解题方法
8 . 硅铝合金广泛应用于航空、交通、建筑、汽车等行业。
完成下列填空:
(1)硅原子的结构示意图为___________ ;比较硅铝的原子半径:r(Si)___________ r(Al)(选填:“>”、“<”或“=”)。硅铝合金中的铝与氢氧化钠溶液反应的化学方程式为___________ 。
(2)氟化铝和氯化铝的熔点分别为1040 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是___________ 。
(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为___________ ,推断的依据是___________ 。
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;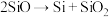 ;
;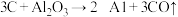
上述反应的最终还原产物为___________ ;当有1mol C参加反应时,转移的电子数目为___________ 。
完成下列填空:
(1)硅原子的结构示意图为
(2)氟化铝和氯化铝的熔点分别为1040
 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;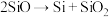 ;
;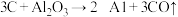
上述反应的最终还原产物为
您最近一年使用:0次
2021-04-20更新
|
410次组卷
|
3卷引用:上海市浦东新区2021届高三二模化学试题
上海市浦东新区2021届高三二模化学试题(已下线)第15讲 原子结构 化学键(练)-2023年高考化学一轮复习讲练测(全国通用)上海市奉贤区致远高级中学2021-2022学年高二上学期期末教学评估(等级考)化学试题
名校
解题方法
9 . 回答下列问题:
(1)原子核外电子是分层排布的,当N层为最外层时,最多可容纳电子数是______ ;
(2)某元素原子,L层上的电子数是M层电子数的两倍,中子数为15,可表示相关信息的原子符号为______ ;
(3)原子核外电子排布可以用原子结构示意图简明的表示,如:
a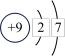 b
b c
c d
d
微粒d在化学反应中容易______ (选填“得到”或“失去”)电子,达到______ 结构;这些微粒中的稀有气体元素原子的电子式是______ ;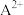 和
和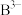 两种离子的核外电子排布与这种稀有气体原子的核外电子排布相同,则
两种离子的核外电子排布与这种稀有气体原子的核外电子排布相同,则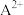 的结构示意图为
的结构示意图为______ ,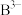 的电子式为
的电子式为______ 。
(1)原子核外电子是分层排布的,当N层为最外层时,最多可容纳电子数是
(2)某元素原子,L层上的电子数是M层电子数的两倍,中子数为15,可表示相关信息的原子符号为
(3)原子核外电子排布可以用原子结构示意图简明的表示,如:
a
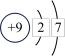 b
b c
c d
d
微粒d在化学反应中容易
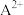 和
和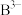 两种离子的核外电子排布与这种稀有气体原子的核外电子排布相同,则
两种离子的核外电子排布与这种稀有气体原子的核外电子排布相同,则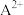 的结构示意图为
的结构示意图为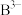 的电子式为
的电子式为
您最近一年使用:0次
20-21高一·全国·课时练习
10 . 请在下列问题的横线上填上合适的短周期元素符号:
(1)某元素原子核外最外层电子数是内层电子总数的2倍,该元素可能是___________ 。
(2)某元素原子核外最外层电子数是次外层电子数的2倍,该元素可能是___________ 。
(3)某元素原子核外最外层电子数是内层电子总数的 ,该元素可能是
,该元素可能是___________ 。
(4)某元素原子核外最外层电子数是次外层电子数的 ,该元素可能是
,该元素可能是___________ 。
(1)某元素原子核外最外层电子数是内层电子总数的2倍,该元素可能是
(2)某元素原子核外最外层电子数是次外层电子数的2倍,该元素可能是
(3)某元素原子核外最外层电子数是内层电子总数的
 ,该元素可能是
,该元素可能是(4)某元素原子核外最外层电子数是次外层电子数的
 ,该元素可能是
,该元素可能是
您最近一年使用:0次



