1 . 科学家们用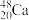 原子轰击某种铬原子,得到了
原子轰击某种铬原子,得到了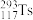 原子。已知
原子。已知
(1)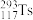 的原子结构示意图是
的原子结构示意图是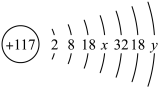 ,其中的x=
,其中的x=_______ ,y=_______ 。
(2)Ts位于元素周期表的第_______ 周期,第_______ 族,与它属于同族的一种元素是_______ 。(填元素符号)
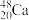 原子轰击某种铬原子,得到了
原子轰击某种铬原子,得到了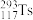 原子。已知
原子。已知(1)
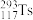 的原子结构示意图是
的原子结构示意图是 ,其中的x=
,其中的x=(2)Ts位于元素周期表的第
您最近一年使用:0次
解题方法
2 . 我国自主研制的C919大型客机的机身大量采用第三代铝锂合金减重并提高刚度。某铝锂合金成分(质量百分比)如下(Bal指剩余的百分含量):

为了使合金具有高耐腐性能,通常先用酸腐蚀除去铝锂合金表面的氧化层,再进行氧化处理,并进行适当封闭,以提高合金表面耐腐蚀性能。仔细阅读上述信息,回答下列问题:
(1)铝锂合金可用于制造飞机,铝锂合金材料的主要特点是______________________________ 。
(2)铝元素原子核外有_____ 种不同运动状态的电子,最外层电子排布式为___________ 。
(3)碱腐蚀工艺采用40~60g/L的NaOH溶液,在40~55℃下处理0.5~2min时间。写出碱腐蚀主要反应的化学方程式_____________________________ (写一个即可)。
(4) 镁与铝也是构成轻合金的两种常见金属,请从原子结构角度分析比较它们金属性的强弱_____________
(5) 向镁铝合金滴入盐酸至恰好全部溶解,再逐渐滴入氢氧化钠溶液至过量,在滴氢氧化钠过程中观察到的现象有:______________________________________ ;写出其现象中的一个离子方程式_________________ 。

| 成分 | Si | Fe | Cu | Mn | Mg | Zn | Ti | Li | Al |
| 含量 | 0.08 | 0.1 | 2.9~3.5 | 0.5 | 0.25~0.8 | 0.25 | 0.1 | 0.8~1.1 | Bal |
(1)铝锂合金可用于制造飞机,铝锂合金材料的主要特点是
(2)铝元素原子核外有
(3)碱腐蚀工艺采用40~60g/L的NaOH溶液,在40~55℃下处理0.5~2min时间。写出碱腐蚀主要反应的化学方程式
(4) 镁与铝也是构成轻合金的两种常见金属,请从原子结构角度分析比较它们金属性的强弱
(5) 向镁铝合金滴入盐酸至恰好全部溶解,再逐渐滴入氢氧化钠溶液至过量,在滴氢氧化钠过程中观察到的现象有:
您最近一年使用:0次
解题方法
3 . 下列关于碳和碳的化合物的结构和性质中
(1)和碳同一主族的硅原子中能量最高的电子处在______ 电子层上(填写电子层符号),最外层有___ 种运动状态不同的电子,碳原子核外有______ 种能量不同的电子,有______ 种不同形状的电子云.
(2)1个C原子的单键氢化物分子是CH4,2个C原子的单键氢化物分子则为C2H6.以下各对分子间不存在类似关系的是_________
A.NH3与N2H4 B.H2O与H2O2 C.SF6与S2F10 D.SCl4与S2Cl2
(3)金刚石的熔点低于石墨,原因可能是________
A.石墨中还有范德华力
B.石墨熔化也要破坏共价键,且键长更短
C.石墨热稳定性更好
(4)已知常温下,H2CO3:Ki1=4.3x10﹣7、Ki2=5.6x10﹣11.结合H+的能力Na2CO3溶液______ (填”>”、”<”或“=”)NaHCO3溶液,设计简单实验证明:______ .
(5)在1L 0.3mol/L的NaOH溶液中,通入4.48LCO2(标准状况),反应后所得溶液中离子的浓度之间有一些等量关系,例如:.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),另外对此溶液中存在的离子按浓度由大到小排序为______ .
(1)和碳同一主族的硅原子中能量最高的电子处在
(2)1个C原子的单键氢化物分子是CH4,2个C原子的单键氢化物分子则为C2H6.以下各对分子间不存在类似关系的是
A.NH3与N2H4 B.H2O与H2O2 C.SF6与S2F10 D.SCl4与S2Cl2
(3)金刚石的熔点低于石墨,原因可能是
A.石墨中还有范德华力
B.石墨熔化也要破坏共价键,且键长更短
C.石墨热稳定性更好
(4)已知常温下,H2CO3:Ki1=4.3x10﹣7、Ki2=5.6x10﹣11.结合H+的能力Na2CO3溶液
(5)在1L 0.3mol/L的NaOH溶液中,通入4.48LCO2(标准状况),反应后所得溶液中离子的浓度之间有一些等量关系,例如:.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),另外对此溶液中存在的离子按浓度由大到小排序为
您最近一年使用:0次
4 . 铁、铜、铬、镍及其化合物在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________ ,基态铁原子价电子排布式为___________ 。
(2)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,PO43-的空间构型是______________ ,P、S元素第一电离能大小关系为_______________ 。
(3)镍可与CO形成配合物Ni(CO)n,CO分子与N2互为等电子体,则中CO分子σ键与π键的个数比为________ ;该配合物的熔点是170℃,则Ni(CO)n 属于 _______ 晶体。
(4)在铬的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______ ,乙醇极易溶于水,其主要原因是_______________ 。
(5)立方NiO晶体结构类似于NaCl,则Ni2+的配位数为________ ,其晶胞边长为a cm,列式表示NiO晶体的密度为____ g/cm3(不必计算出结果,阿伏伽德罗常数的值为NA)。
(1)铁在元素周期表中的位置是
(2)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,PO43-的空间构型是
(3)镍可与CO形成配合物Ni(CO)n,CO分子与N2互为等电子体,则中CO分子σ键与π键的个数比为
(4)在铬的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是
(5)立方NiO晶体结构类似于NaCl,则Ni2+的配位数为
您最近一年使用:0次
2017-07-01更新
|
482次组卷
|
2卷引用:四川省广安市2016-2017学年高二下学期期末考试化学试题
名校
5 . 铅的合金可作轴承、电缆外皮之用,还可做体育器材铅球等。铅元素位于元素周期表第六周期IVA,IVA中原子序数最小的元素的原子有___ 种能量不同的电子,其次外层的电子云有___ 种不同的伸展方向。与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是___ (填化学式),气态氢化物沸点最低的是___ (填化学式)。
您最近一年使用:0次
解题方法
6 . 填表
| 微粒 | 核外电子数 | 中子数 | 质量数 | 最外层电子数 |
 Cl Cl | ||||
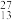 Al Al | ||||
 S2- S2- |
您最近一年使用:0次
2021高三·全国·专题练习
7 . 硒和铬元素都是人体必需的微量元素,硒与氧为同主族元素,硒的原子结构示意图为____ 。
您最近一年使用:0次
解题方法
8 . 金属“钙线”是炼制优质钢材的脱氧脱磷剂,某“钙线”的主要成分为金属M和Ca。
(1)Ca元素在元素周期表中的位置是_____ ,最外层电子排布式为________ 。
(2)CaF2的电子式为_____ ,CaF2熔点比SiF4熔点_______ (选填“高”、“低”或“相同”),原因是_____ 。
(3)将“钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为_____ ,检测Mn+的另一种方法是_____ 。
(4)配平下列化学方程式: P+ FeO+ CaO→ Ca3(PO4)2+ Fe,________ ,若生成的Fe为2.8g,则转移的电子数目为_____ 个。
(1)Ca元素在元素周期表中的位置是
(2)CaF2的电子式为
(3)将“钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为
(4)配平下列化学方程式: P+ FeO+ CaO→ Ca3(PO4)2+ Fe,
您最近一年使用:0次
解题方法
9 . 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子核外电子排布式为___ 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___ (填序号)。
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如图转化可制得KClO3晶体:
NaCl溶液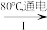 NaClO3溶液
NaClO3溶液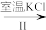 KClO3晶体
KClO3晶体
II中转化的基本反应类型是___ ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是___ 。
(4)晶体硅(熔点1410℃)是良好的半导体材料;四氯化硅熔点-70℃,沸点57.6℃;由粗硅制纯硅过程如图:
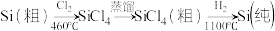
写出SiCl4的电子式:___ ;在上述由SiCl4制纯硅的反应中,测得生成7kg纯硅需吸收akJ热量,写出该反应的热化学方程式:___ 。
(5)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目___ 。
(1)与氯元素同族的短周期元素的原子核外电子排布式为
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如图转化可制得KClO3晶体:
NaCl溶液
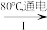 NaClO3溶液
NaClO3溶液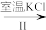 KClO3晶体
KClO3晶体II中转化的基本反应类型是
(4)晶体硅(熔点1410℃)是良好的半导体材料;四氯化硅熔点-70℃,沸点57.6℃;由粗硅制纯硅过程如图:
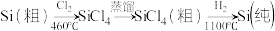
写出SiCl4的电子式:
(5)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目
您最近一年使用:0次
10 . 画出下列各微粒的结构示意图:
(1)与氖原子电子层结构相同的-2价阴离子:______________________________ 。
(2)最外层电子数为次外层电子数2倍的原子:______________________________ 。
(3)第2层电子数为第1层、第3层电子数之和的原子:______________________ 。
(1)与氖原子电子层结构相同的-2价阴离子:
(2)最外层电子数为次外层电子数2倍的原子:
(3)第2层电子数为第1层、第3层电子数之和的原子:
您最近一年使用:0次



