名校
1 . 表中①~⑥为短周期元素及相应部分原子半径的数据。下列说法正确的是
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径/nm | a | 0.075 | b | 0.110 | c | d |
| 最高化合价 | +6 | +5 | +5 | +7 | ||
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
| A.原子半径:a>d>b>c |
| B.元素①的最外层电子排布为2s22p4 |
| C.元素②氢化物与元素⑥氢化物反应形成化合物中只有价键 |
D.非金属性:元素⑤ 元素④ 元素④ 元素① 元素① |
您最近一年使用:0次
2 . 磷是人体所必需的重要矿物质元素,磷的化合物在生产和生活中应用广泛。
反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)磷原子的核外电子排布式:___________ ;磷原子核外有_____ 种能量不同的电子。
(2)上述反应的反应物和生成物中含有非极性键的分子是______ 。(写出物质的化学式)
(3)将Na、O、P三种原子的原子半径大小按由大到小的顺序排列___________________ 。
(4)NH3的稳定性比PH3的(填“强”或“弱”)_________ ,判断理由是____________ 。
(5)A、配平上述反应,并标出电子转移方向与数目_________
P4+ NaOH+ H2O→ NaH2PO2 + PH3
B、上述反应中每生成1 mol 氧化产物,转移电子的数目为___________ 。
反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)磷原子的核外电子排布式:
(2)上述反应的反应物和生成物中含有非极性键的分子是
(3)将Na、O、P三种原子的原子半径大小按由大到小的顺序排列
(4)NH3的稳定性比PH3的(填“强”或“弱”)
(5)A、配平上述反应,并标出电子转移方向与数目
P4+ NaOH+ H2O→ NaH2PO2 + PH3
B、上述反应中每生成1 mol 氧化产物,转移电子的数目为
您最近一年使用:0次
名校
解题方法
3 . A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图。
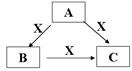
请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,向C的水溶液中通入过量的CO2可得B的白色胶状沉淀。
①A中含有的金属元素为_________ (写元素名称),它在周期表中的位置为_____________ 。
②写出B → C反应的离子方程式为___________________________________ 。
(2)若A为稀HNO3,X为常见黑色金属单质,写出A→B反应的离子方程式__________ 。
(3)若A、B、C三种化合物的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是________________
②自然界中存在B、C和H2O按一定比例结晶而成的固体,取一定量该固体溶于水配成一定物质的量浓度的溶液100mL,所用到的玻璃仪器有玻璃棒、烧杯、________ 、_________ 。
③若测得上述溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为____________ g 。

请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,向C的水溶液中通入过量的CO2可得B的白色胶状沉淀。
①A中含有的金属元素为
②写出B → C反应的离子方程式为
(2)若A为稀HNO3,X为常见黑色金属单质,写出A→B反应的离子方程式
(3)若A、B、C三种化合物的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是
②自然界中存在B、C和H2O按一定比例结晶而成的固体,取一定量该固体溶于水配成一定物质的量浓度的溶液100mL,所用到的玻璃仪器有玻璃棒、烧杯、
③若测得上述溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为
您最近一年使用:0次
名校
解题方法
4 . A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18,A原子的最外层电子比B原子的最外层电子少2个,B原子的质子数是其电子层数的4倍。A、B、C三种元素能结合成化合物C2AB3,在lmolC2AB3中共有52mol电子。D元素的单质0.5mol与酸全部反应时,有9.03×1023个电子转移。E元素的单质是一种黄绿色气体,水溶液具有漂白性。试填写下列空白:
(1)写出元素A 和E的名称:A_______ ,E_______ 。
(2)元素B在周期表中的位置为第二周期_______ 族。
(3)由元素B、C形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为含有_______ 键(填“极性”或“非极性”)的_______ 化合物(填“离子”或“共价”) ,写出该化合物的电子式_______ 。
(4)写出C、D两种元素对应的最高价氧化物的水化物相互反应的离子方程式_______ 。
(1)写出元素A 和E的名称:A
(2)元素B在周期表中的位置为第二周期
(3)由元素B、C形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为含有
(4)写出C、D两种元素对应的最高价氧化物的水化物相互反应的离子方程式
您最近一年使用:0次
2016-12-09更新
|
595次组卷
|
4卷引用:2015-2016学年江苏省泰州中学高一下第一次月考化学试卷
2015-2016学年江苏省泰州中学高一下第一次月考化学试卷2016-2017学年湖南省株洲市第二中学高一下学期第一次月考化学试卷《课时同步君》2017-2018学年高一化学人教必修2-1.3 化学键(已下线)精做03 化学键——《大题精做》2017-2018学年高一化学人教必修2
解题方法
5 . 已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子。R+核外有28个电子。请回答下列问题(用所对应的元素符号表示)。
(1)R在基态时价层电子排布式为________ 。
(2)写出R单质与A2G2及M最高价氧化物对应水合物反应的离子方程式___________ 。
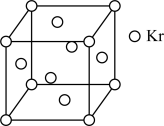
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NGX、G3、等二次污染物。测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=__ (填数字)。
(4)1 mol晶体L中含有σ键的数目为________ 。
(5)G与M可形成MG3与MG2,MG3分子的空间构型是___ ,
MG2中M原子的杂化方式___ 。
(6)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有________ (填字母)。
a.离子键b.氢键c.配位键d.金属键
(1)R在基态时价层电子排布式为
(2)写出R单质与A2G2及M最高价氧化物对应水合物反应的离子方程式
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NGX、G3、等二次污染物。测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=

(4)1 mol晶体L中含有σ键的数目为
(5)G与M可形成MG3与MG2,MG3分子的空间构型是
MG2中M原子的杂化方式
(6)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有
a.离子键b.氢键c.配位键d.金属键
您最近一年使用:0次
解题方法
6 . 【化学——选修3:物质结构与性质】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
A通常显____ 价,A的电负性______ B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因___________ ;组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 __________________ ;
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:

则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:_______________ ;其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 _______ 个。
(4)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有_____________ (填字母);
A.金属键
B.离子键
C.极性键
D.非极性键
E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为______ g/cm3(用含a、NA的式子表示)。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有
A.金属键
B.离子键
C.极性键
D.非极性键
E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为
您最近一年使用:0次
11-12高三上·甘肃天水·阶段练习
解题方法
7 . 短周期元素A、B、C、D、E的原子序数依次增大,已知:
①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐;
②A的氧化物是生活中最常见液体,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种离子化合物F,1 molF中含有10mol原子。
请回答下列问题:
(1)C的气态氢化物的电子式为______ ,A在周期表中的位置______
(2)化合物E2D2中阴阳离子个数比为______ ,F含有的化学键类型为______
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为______
(4)氯气与C的气态氢化物相遇有白烟及C2生成,写出其化学反应方程式并用单线桥表示电子转移的方向和数目______
(5)将A2、D2分别充人多孔性石墨电极,将电极插入EDA的水溶液中构成原电池,负极的电极反应为______ ;一段时间后EDA的浓度将______ (填“变大”、“变小”、“不变”或“无法确定”)。
①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐;
②A的氧化物是生活中最常见液体,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种离子化合物F,1 molF中含有10mol原子。
请回答下列问题:
(1)C的气态氢化物的电子式为
(2)化合物E2D2中阴阳离子个数比为
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为
(4)氯气与C的气态氢化物相遇有白烟及C2生成,写出其化学反应方程式并用单线桥表示电子转移的方向和数目
(5)将A2、D2分别充人多孔性石墨电极,将电极插入EDA的水溶液中构成原电池,负极的电极反应为
您最近一年使用:0次



