1 . 下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
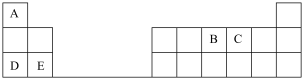
完成下列填空(填元素符号或化学式):
(1)元素C在元素周期表中的位置是__________ ,B、C、E三种元素原子半径从大到小的顺序是__________ ;
(2)D简单离子的结构示意图为______________ ,D的金属性________ E的金属性(填“大于”“小于”“等于”)。D单质在空气中燃烧可生成淡黄色粉末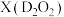 ,
, 的电子式为
的电子式为___________ ,D的最高价氧化物对应的水化物中含有的化学键类型有_________ 。
(3)将 、
、 的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入
的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入 的盐酸,所加盐酸的体积与产生
的盐酸,所加盐酸的体积与产生 的体积(标准状况)关系如图所示。
的体积(标准状况)关系如图所示。
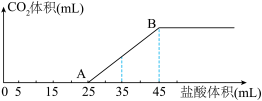
已知:逐滴将盐酸加入碳酸钠溶液中时,盐酸先与碳酸钠反应生成碳酸氢钠。
①AB段发生反应的离子方程式为____________ 。
②原固体混合物中 与
与 的物质的量之比为
的物质的量之比为____________ 。

完成下列填空(填元素符号或化学式):
(1)元素C在元素周期表中的位置是
(2)D简单离子的结构示意图为
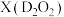 ,
, 的电子式为
的电子式为(3)将
 、
、 的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入
的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入 的盐酸,所加盐酸的体积与产生
的盐酸,所加盐酸的体积与产生 的体积(标准状况)关系如图所示。
的体积(标准状况)关系如图所示。
已知:逐滴将盐酸加入碳酸钠溶液中时,盐酸先与碳酸钠反应生成碳酸氢钠。
①AB段发生反应的离子方程式为
②原固体混合物中
 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
2 . A、B、C、D、E是原子序数依次增大并分属四个周期的前20号主族元素。B、C相邻且C原子的最外层电子数是内层电子数的3倍,D、E能形成化合物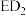 。
。
(1)B在元素周期表中的位置是___________ ,化合物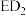 的电子式为
的电子式为___________ 。
(2)A与B、C形成的简单化合物的稳定性相对强弱为___________ (用化学式表示);化合物 中的化学键类型为
中的化学键类型为___________ 。
(3)科学研究发现化合物BC具有“扩张血管和增强免疫力、记忆力”的功能,故它成为当前生命科学研究中的“明星分子”。一定条件下该“明星分子”可转化为化合物B,C与另一种常见的红棕色气体,写出反应的化学方程式:___________ ,同温同体积条件下,该反应完全转化后,容器内反应前后的压强比为___________ 。
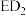 。
。(1)B在元素周期表中的位置是
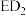 的电子式为
的电子式为(2)A与B、C形成的简单化合物的稳定性相对强弱为
 中的化学键类型为
中的化学键类型为(3)科学研究发现化合物BC具有“扩张血管和增强免疫力、记忆力”的功能,故它成为当前生命科学研究中的“明星分子”。一定条件下该“明星分子”可转化为化合物B,C与另一种常见的红棕色气体,写出反应的化学方程式:
您最近一年使用:0次
3 . 元素周期表的建立和元素周期律的发现,揭示了元素“位”“构”“性”之间的内在联系,可以根据“位”“构”的特点预测和解释元素的性质。下图是元素周期表的一部分,请回答下列问题:
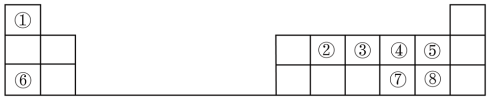
(1)元素⑦在周期表中的位置是
(2)元素③、④的原子半径大小关系正确的是
(3)元素④、⑦的非金属性强弱关系正确的是
(4)元素①、⑧形成化合物的电子式正确的是
(5)元素②有多种同位素,这些同位素具有相同的
(6)下列各组元素形成的化合物中只含有离子键的是

(1)元素⑦在周期表中的位置是
| A.第二周期、第ⅣA族 | B.第二周期、第ⅥA族 |
| C.第三周期、第ⅣA族 | D.第三周期、第ⅥA族 |
| A.③>④ | B.③<④ | C.③=④ | D.无法确定 |
| A.④>⑦ | B.④<⑦ | C.④=⑦ | D.无法确定 |
| A.HCl | B.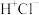 | C.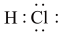 | D.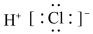 |
| A.质量数和电子数 | B.质子数和电子数 |
| C.质子数和中子数 | D.质量数和中子数 |
| A.①和④ | B.②和④ | C.①和⑤ | D.⑥和⑧ |
您最近一年使用:0次
名校
解题方法
4 . X、Y、Z、Q、W、R是常见的短周期主族元素,其相关信息如下表:
(1)元素X在元素周期表中的位置是___________ 。
(2)上述六种元素中有2种元素能形成一种淡黄色的固体化合物,该化合物的电子式是___________ , 所含化学键的类型有___________ 。
(3)Y、Q、R三种元素的简单氢化物中,稳定性最强的化合物的结构式为___________ 。
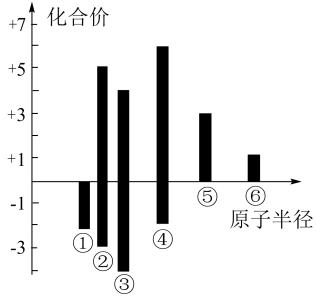
(4)上述六种元素原子半径与主要化合价的关系如图,其中④对应的元素为___________ (填名称)。
(5)将RQ2通入BaCl2溶液中,没有明显变化,再向其中加入Z的最高价氧化物的水化物,可观察到的现象是___________ ,发生反应的离子方程式是___________ 。
| 元素 | 相关信息 |
| X | 它的一种同位素被用作相对原子质量的标准 |
| Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Z | 是短周期中(除稀有气体外)原子半径最大的元素 |
| Q | 最外层电子数是次外层电子数的3倍 |
| W | 原子序数等于X、Y原子序数之和 |
| R | 与Q同族,且最高价氧化物的水化物的浓溶液常温下使W单质钝化 |
(2)上述六种元素中有2种元素能形成一种淡黄色的固体化合物,该化合物的电子式是
(3)Y、Q、R三种元素的简单氢化物中,稳定性最强的化合物的结构式为
(4)上述六种元素原子半径与主要化合价的关系如图,其中④对应的元素为

(5)将RQ2通入BaCl2溶液中,没有明显变化,再向其中加入Z的最高价氧化物的水化物,可观察到的现象是
您最近一年使用:0次
名校
5 . 元素周期表揭示了元素之间的内在联系,使元素构成了一个较为系统的体系.请回答下列问题:
Ⅰ.元素周期表的建立与完善是一个渐进的过程.直至20世纪初,原子结构奥秘被揭示后,元素周期表中元素的排序由依据相对原子质量改为依据原子的_______ 。按照元素在周期表中的顺序给元素编号,得到原子序数。人们发现原子序数与元素的原子结构之间存在如下关系:原子序数=_______ =核外电子数
Ⅱ.图为元素周期表的一部分,序号①~⑥分别代表周期表中相应位置的种元素。
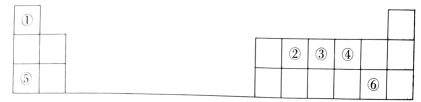
(1)②、③、④三种元素中,原子半径由大到小的顺序为_______ (用元素符号表示)。
(2)①、④、⑤三种元素形成的化合物的电子式为_______ ,该化合物中化学键的类型有_______ 。
(3)元素Q位于第四周期,且与元素⑥均为同一主族元素。请用离子方程说明⑥和Q两种元素单质氧化性的强弱:_______ 。根据元素周期律推测,下列性质中Q不可能具有的是_______ (填选项字母)。
A.最高正化合价为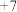 B.气态氢化物比⑥的稳定 C.单质在常温下可与氢气化合
B.气态氢化物比⑥的稳定 C.单质在常温下可与氢气化合
Ⅰ.元素周期表的建立与完善是一个渐进的过程.直至20世纪初,原子结构奥秘被揭示后,元素周期表中元素的排序由依据相对原子质量改为依据原子的
Ⅱ.图为元素周期表的一部分,序号①~⑥分别代表周期表中相应位置的种元素。

(1)②、③、④三种元素中,原子半径由大到小的顺序为
(2)①、④、⑤三种元素形成的化合物的电子式为
(3)元素Q位于第四周期,且与元素⑥均为同一主族元素。请用离子方程说明⑥和Q两种元素单质氧化性的强弱:
A.最高正化合价为
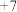 B.气态氢化物比⑥的稳定 C.单质在常温下可与氢气化合
B.气态氢化物比⑥的稳定 C.单质在常温下可与氢气化合
您最近一年使用:0次
2021-01-28更新
|
172次组卷
|
2卷引用:山西省2020-2021学年高一上学期期末考试化学试题
名校
解题方法
6 . 回答下列问题:
(1)已知有下列物质:①HNO3;②NaOH;③液氦;④Na2O2;⑤H2O2;⑥CCl4;⑦NH4Cl;⑧KBr,分别将正确的序号填入相应的位置。以上物质中只含有离子键的是_______ ;只含有共价键的是_______ ;含有非极性共价键的离子化合物是_______ ;不含化学键的是_______ 。
(2)在完整的周期表中第三周期半径最大的主族元素,该元素单质与氧气在加热条件下反应,得到产物R,则R中阴离子与阳离子个数比为:_______ 。
(3)硒(Se)化铟(In)是一种新型半导体材料。下列说法正确的是_______(填序号)。
(4)已知短周期四种主族元素分别形成的离子X+、Y2+、Zˉ、W2ˉ均具有相同的电子层结构,则X、Y、Z、W这四种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(5)A+、Bˉ、C、D四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ C+D↑,则A+的电子式为
C+D↑,则A+的电子式为_______ ;比较C和D的稳定性的强弱:_______ (用化学式表示)。
(6)质量相同的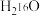 和
和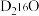 所含中子数之比为
所含中子数之比为_______ 。
(1)已知有下列物质:①HNO3;②NaOH;③液氦;④Na2O2;⑤H2O2;⑥CCl4;⑦NH4Cl;⑧KBr,分别将正确的序号填入相应的位置。以上物质中只含有离子键的是
(2)在完整的周期表中第三周期半径最大的主族元素,该元素单质与氧气在加热条件下反应,得到产物R,则R中阴离子与阳离子个数比为:
(3)硒(Se)化铟(In)是一种新型半导体材料。下列说法正确的是_______(填序号)。
| A.原子半径:In>Se | B.In比Se易失去电子 |
| C.In的金属性比Al弱 | D.硒化铟的化学式为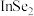 |
(5)A+、Bˉ、C、D四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ
 C+D↑,则A+的电子式为
C+D↑,则A+的电子式为(6)质量相同的
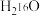 和
和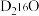 所含中子数之比为
所含中子数之比为
您最近一年使用:0次



