解题方法
1 . 钠元素在自然界中分布很广,储量极为丰富,都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。钠单质和钠的化合物在生产、生活中被广泛应用。请根据钠及其化合物性质按要求完成各题。
(1)钠原子在周期表中的位置为___________ ,钠离子的结构示意图___________ 。
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有___________ (填化学式,下同),既含有离子键又含有共价键的有___________ ,只含共价键的有___________ 。
(3)钠的化学性质活泼,暴露在空气中生成___________ 色Na2O,在空气中加热,生成___________ 色的Na2O2,Na2O2可用作呼吸面具、潜水艇的供氧剂,写出Na2O2和CO2反应的化学方程式:___________ 。
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
(5)下列有关物质的性质描述正确的是____。
(6)Na2CO3和NaHCO3是常见的钠盐,且两者之间可以相互转化,请回答下列问题:
①下列有关碳酸钠和碳酸氢钠的说法正确的是____ 。
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式___________ ;
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为___________ ;
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为____ 。
A.42% B.44% C.56% D.58%
(1)钠原子在周期表中的位置为
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有
(3)钠的化学性质活泼,暴露在空气中生成
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
| A.钠熔化成银白色小球 | B.钠在水面上迅速游动 |
| C.发出嘶嘶的声响 | D.溶液逐渐变红色 |
| A.钠与氧气反应时的产物主要取决于氧气的用量及纯度 |
| B.钠投入硫酸铜溶液中有气体和蓝色沉淀产生 |
| C.Na2O和Na2O2分别溶于水中,所得的产物相同 |
| D.FeCl3溶液用于铜质印刷线路制作,原因是两者发生置换反应 |
①下列有关碳酸钠和碳酸氢钠的说法正确的是
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为
A.42% B.44% C.56% D.58%
您最近一年使用:0次
名校
2 . A、B、C、D、E、F是原子序数依次增大的6种短周期主族元素。A元素是动植物生长不可缺少的元素,其单质在空气中含量最高;B元素的最外层电子数是其电子层数的3倍;短周期主族元素中C原子半径最大;C、D、E的最高价氧化物对应水化物两两之间都能反应,元素E最高正化合价与最低负化合价的代数和为4。回答下列问题:
(1)A元素组成单质的电子式_____________ 。E和F的最高价氧化物对应水化物酸性更强的是_____________ (填化学式)。
(2)B、C、D、E四种元素简单离子的离子半径由大到小 的顺序是(填具体的离子符号):______________________ ;
(3)C和B能形成C2B和C2B2两种化合物,用电子式请写出C2B2的形成过程:
_________________________________ 。
(4)已知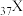 和
和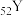 都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
(5)下列物质的变化中未发生化学键破坏的是_____________ (填序号,下同),仅发生离子键破坏的是_____________ ,仅发生共价键破坏的是_____________ ,既发生离子键破坏,又发生共价键破坏的是________________________ .
①氯化钠溶于水、②氯化氢溶于水、③乙醇溶于水、④过氧化钠与水反应、⑤碘升华.
(6)A、B组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐和水。请写出该反应的离子方程式_____________ 。
(1)A元素组成单质的电子式
(2)B、C、D、E四种元素简单离子的离子半径
(3)C和B能形成C2B和C2B2两种化合物,用电子式请写出C2B2的形成过程:
(4)已知
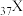 和
和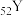 都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);| A.原子半径:X>Y | B.最高价氧化物对应水化物的碱性强弱:X>C |
| C.气态氢化物稳定性强弱:E>Y | D.B与C形成的化合物中不可能含有共价键 |
①氯化钠溶于水、②氯化氢溶于水、③乙醇溶于水、④过氧化钠与水反应、⑤碘升华.
(6)A、B组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐和水。请写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
3 . 完成下列问题
(1)下列变化过程中有可能不涉及氧化还原反应的是_______
(2)氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。下列叙述与氮元素的循环无关的是____
(3)关于新制饱和氯水,下列叙述正确的是_______
(4)下列实验中,能实现不同价态含硫物质的转化的是_______
(5)据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如图所示。下列有关该历程的说法错误的是_____

(6)高锰酸钾是生活中常用的一种消毒剂,也常被用于物质成分分析。二氧化锰是制取高锰酸钾的重要原料。制取高锰酸钾的方法是先用二氧化锰制取锰酸钾(K2MnO4),再转化为高锰酸钾。反应过程如下:
i.______MnO2+________KOH+____KClO3 ____K2MnO4+____KCl+____H2O
____K2MnO4+____KCl+____H2O
ii.3K2MnO4+4HCl=2KMnO4+4KCl+2H2O+MnO2
①下列反应中二氧化锰做氧化剂的是___________
a.实验室用氯酸钾和二氧化锰的混合物加热制取氧气
b.实验室用二氧化锰和浓盐酸混合加热制取氯气
c.用二氧化锰和铝混合发生铝热反应制取锰
d.用二氧化锰、氢氧化钾、氯酸钾共熔制取锰酸钾(K2MnO4)
②设计实验证明二氧化锰中含有哪种类型的化学键。(写出实验步骤、现象和结论)_________
③配平反应i的化学方程式_________ 。
④标出反应ii中电子转移的方向和数目_________ 。
⑤若工业上使用纯度为87%的软锰矿(主要成分为二氧化锰)制取高锰酸钾,理论上10吨软锰矿可制取高锰酸钾___________ 吨。
(1)下列变化过程中有可能不涉及氧化还原反应的是_______
| A.钝化 | B.漂白 | C.固氮 | D.燃烧 |
(2)氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。下列叙述与氮元素的循环无关的是____
| A.工业合成氨的过程是固氮的过程 |
| B.自然界中,氨是动物体特别是蛋白质腐败后的产物 |
| C.为防止粮食、罐头、水果等食品腐烂,常用氮气作保护气 |
| D.在雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收 |
(3)关于新制饱和氯水,下列叙述正确的是_______
| A.加入适量NaOH,溶液黄绿色褪去,说明氯水中含有Cl2分子 |
| B.加入少量NaCl粉末,溶液漂白性增强 |
| C.加入少量的碳酸钠粉末,pH增大,溶液漂白性一定减弱 |
| D.光照过程中,有气泡冒出,溶液的导电性减弱 |
(4)下列实验中,能实现不同价态含硫物质的转化的是_______
| A.向含足量NaOH的Na2S溶液中加入Na2SO3 |
| B.常温下,向试管中加入1mL浓硫酸和一小块铜片 |
| C.将0.5g硫粉和1.0g铁粉均匀混合,在石棉网上用红热玻璃棒触及粉末一端至粉末红热 |
| D.向Na2SO3固体中加入70%的浓硫酸制备SO2 |
(5)据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如图所示。下列有关该历程的说法错误的是_____

| A.O2氧化HBr生成Br2的总反应为:O2+4HBr=2Br2+2H2O |
| B.中间体HOOBr和HOBr中Br的化合价相同 |
| C.发生步骤②时,断裂的化学键既有极性键又有非极性键 |
| D.步骤③中,每生成1molBr2转移2mol电子 |
(6)高锰酸钾是生活中常用的一种消毒剂,也常被用于物质成分分析。二氧化锰是制取高锰酸钾的重要原料。制取高锰酸钾的方法是先用二氧化锰制取锰酸钾(K2MnO4),再转化为高锰酸钾。反应过程如下:
i.______MnO2+________KOH+____KClO3
 ____K2MnO4+____KCl+____H2O
____K2MnO4+____KCl+____H2Oii.3K2MnO4+4HCl=2KMnO4+4KCl+2H2O+MnO2
①下列反应中二氧化锰做氧化剂的是
a.实验室用氯酸钾和二氧化锰的混合物加热制取氧气
b.实验室用二氧化锰和浓盐酸混合加热制取氯气
c.用二氧化锰和铝混合发生铝热反应制取锰
d.用二氧化锰、氢氧化钾、氯酸钾共熔制取锰酸钾(K2MnO4)
②设计实验证明二氧化锰中含有哪种类型的化学键。(写出实验步骤、现象和结论)
③配平反应i的化学方程式
④标出反应ii中电子转移的方向和数目
⑤若工业上使用纯度为87%的软锰矿(主要成分为二氧化锰)制取高锰酸钾,理论上10吨软锰矿可制取高锰酸钾
您最近一年使用:0次
4 . X、Y、Z、M为原子序数依次增大的四种短周期元素,它们组成的一种化合物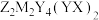 。Y为地壳中含量最高的元素,X与Y可形成一种二元化合物,其在室温下为液态,Z的金属单质可在
。Y为地壳中含量最高的元素,X与Y可形成一种二元化合物,其在室温下为液态,Z的金属单质可在 中燃烧。下列说法正确的是
中燃烧。下列说法正确的是
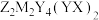 。Y为地壳中含量最高的元素,X与Y可形成一种二元化合物,其在室温下为液态,Z的金属单质可在
。Y为地壳中含量最高的元素,X与Y可形成一种二元化合物,其在室温下为液态,Z的金属单质可在 中燃烧。下列说法正确的是
中燃烧。下列说法正确的是| A.工业上常用电解M的熔融氯化物制取M单质 |
| B.Z和M形成的氧化物均可以作耐高温材料 |
C. 中既有离子键又有共价键 中既有离子键又有共价键 |
D.简单离子半径: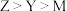 |
您最近一年使用:0次
23-24高一上·江苏·期末
5 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y最外层只有1个电子,Z原子的最外层电子数是X原子最外层电子数的一半,W与X同主族。下列说法正确的是
A.原子半径: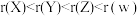 |
| B.Y的最高价氧化物对应水化物的碱性比Z的强 |
| C.W的简单气态氢化物的热稳定性比X的强 |
| D.由X、Y组成的化合物肯定含有极性共价键 |
您最近一年使用:0次
2023-12-21更新
|
545次组卷
|
4卷引用:题型05 元素推断和元素周期律-学易金卷:备战2023-2024学年高一化学期末真题分类汇编(江苏专用)
(已下线)题型05 元素推断和元素周期律-学易金卷:备战2023-2024学年高一化学期末真题分类汇编(江苏专用)(已下线)寒假作业11 化学键-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)江西省宜春市丰城市东煌学校2023-2024学年高三上学期12月月考化学试题云南省丽江润泽高级中学2023-2024学年高一下学期开学考试化学试题
6 . 前三周期主族元素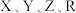 的原子序数依次增大,
的原子序数依次增大, 是地壳中含量最高的元素,
是地壳中含量最高的元素, 的氢化物常用于标记玻璃容器,
的氢化物常用于标记玻璃容器, 的最外层电子数为
的最外层电子数为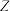 的最外层电子数的三倍
的最外层电子数的三倍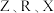 的最外层电子数呈等差数列。下列叙述错误的是
的最外层电子数呈等差数列。下列叙述错误的是
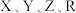 的原子序数依次增大,
的原子序数依次增大, 是地壳中含量最高的元素,
是地壳中含量最高的元素, 的氢化物常用于标记玻璃容器,
的氢化物常用于标记玻璃容器, 的最外层电子数为
的最外层电子数为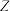 的最外层电子数的三倍
的最外层电子数的三倍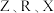 的最外层电子数呈等差数列。下列叙述错误的是
的最外层电子数呈等差数列。下列叙述错误的是A.原子半径: | B.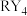 分子具有正四面体结构 分子具有正四面体结构 |
C.与氢形成的共价键键能: | D.Z与Y形成的化合物为离子化合物 |
您最近一年使用:0次
名校
7 . W、X、Y、Z均为短周期元素,原子序数依次增加,Z是地壳中含量最高的元素,M、N是由这些元素组成的二元化合物,M和N转化为R的反应历程与能量关系如图所示。
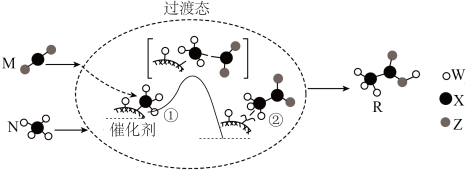
下列叙述错误的是

下列叙述错误的是
| A.M的键角为180° |
| B.①→②放出能量并有非极性键生成 |
| C.上述四种元素只能形成离子化合物。 |
| D.生成R总反应的原子利用率为100% |
您最近一年使用:0次
名校
8 . 甲、乙、丙、丁都是短周期元素,其中甲、丁在周期表中的相对位置如下表所示,甲原子最外层电子数是其内层电子数的2倍,乙单质在空气中燃烧发出黄色火焰,丙是地壳中含量最高的金属元素,下列判断正确的是
| 甲 | |||
| 丁 |
| A.原子半径:丙>乙 |
| B.乙和丁的最高价氧化物的水化物均可和丙单质反应 |
| C.基态甲原子有5种不同的运动状态 |
| D.甲、乙的最高价氧化物均是共价化合物 |
您最近一年使用:0次
2023-05-31更新
|
246次组卷
|
3卷引用:广东省珠海市第一中学2023届高三下学期5月月考化学试题
名校
9 . W、X、Y和Z为原子序数依次增大的短周期主族元素,W原子最外层电子数是次外层电子数的2倍,X是地壳中含量最多的元素,Y元素的原子是短周期中原子半径最大的原子,Z的质子数比W和X的质子数之和少1,下列说法错误的是
| A.原子半径:Y>Z>W>X |
| B.WX2化合物中含有非极性共价键 |
| C.单质的沸点:W>X |
| D.Z与Y元素二者的最高价氧化物对应水化物之间能发生反应 |
您最近一年使用:0次
名校
10 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
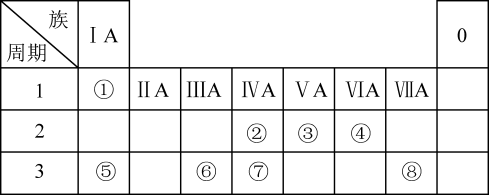
(1)地壳中含量居于第二位的元素在周期表中的位置是___________ 。
(2)②的最高价氧化物的分子式为___________ ;⑥的最高价氧化物对应水化物的分子式为___________ 。
(3)①④⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的化学式:___________ ,___________ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②的最高价氧化物的分子式为
(3)①④⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的化学式:
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
| A.最高正化合价为+6 |
| B.气态氢化物比H2S稳定 |
| C.最高价氧化物对应水化物的酸性比硫酸弱 |
| D.单质在常温下可与氢气化合 |
您最近一年使用:0次



