名校
解题方法
1 . 完成下列问题
(1)下列变化过程中有可能不涉及氧化还原反应的是_______
(2)氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。下列叙述与氮元素的循环无关的是____
(3)关于新制饱和氯水,下列叙述正确的是_______
(4)下列实验中,能实现不同价态含硫物质的转化的是_______
(5)据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如图所示。下列有关该历程的说法错误的是_____

(6)高锰酸钾是生活中常用的一种消毒剂,也常被用于物质成分分析。二氧化锰是制取高锰酸钾的重要原料。制取高锰酸钾的方法是先用二氧化锰制取锰酸钾(K2MnO4),再转化为高锰酸钾。反应过程如下:
i.______MnO2+________KOH+____KClO3 ____K2MnO4+____KCl+____H2O
____K2MnO4+____KCl+____H2O
ii.3K2MnO4+4HCl=2KMnO4+4KCl+2H2O+MnO2
①下列反应中二氧化锰做氧化剂的是___________
a.实验室用氯酸钾和二氧化锰的混合物加热制取氧气
b.实验室用二氧化锰和浓盐酸混合加热制取氯气
c.用二氧化锰和铝混合发生铝热反应制取锰
d.用二氧化锰、氢氧化钾、氯酸钾共熔制取锰酸钾(K2MnO4)
②设计实验证明二氧化锰中含有哪种类型的化学键。(写出实验步骤、现象和结论)_________
③配平反应i的化学方程式_________ 。
④标出反应ii中电子转移的方向和数目_________ 。
⑤若工业上使用纯度为87%的软锰矿(主要成分为二氧化锰)制取高锰酸钾,理论上10吨软锰矿可制取高锰酸钾___________ 吨。
(1)下列变化过程中有可能不涉及氧化还原反应的是_______
| A.钝化 | B.漂白 | C.固氮 | D.燃烧 |
(2)氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。下列叙述与氮元素的循环无关的是____
| A.工业合成氨的过程是固氮的过程 |
| B.自然界中,氨是动物体特别是蛋白质腐败后的产物 |
| C.为防止粮食、罐头、水果等食品腐烂,常用氮气作保护气 |
| D.在雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收 |
(3)关于新制饱和氯水,下列叙述正确的是_______
| A.加入适量NaOH,溶液黄绿色褪去,说明氯水中含有Cl2分子 |
| B.加入少量NaCl粉末,溶液漂白性增强 |
| C.加入少量的碳酸钠粉末,pH增大,溶液漂白性一定减弱 |
| D.光照过程中,有气泡冒出,溶液的导电性减弱 |
(4)下列实验中,能实现不同价态含硫物质的转化的是_______
| A.向含足量NaOH的Na2S溶液中加入Na2SO3 |
| B.常温下,向试管中加入1mL浓硫酸和一小块铜片 |
| C.将0.5g硫粉和1.0g铁粉均匀混合,在石棉网上用红热玻璃棒触及粉末一端至粉末红热 |
| D.向Na2SO3固体中加入70%的浓硫酸制备SO2 |
(5)据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如图所示。下列有关该历程的说法错误的是_____

| A.O2氧化HBr生成Br2的总反应为:O2+4HBr=2Br2+2H2O |
| B.中间体HOOBr和HOBr中Br的化合价相同 |
| C.发生步骤②时,断裂的化学键既有极性键又有非极性键 |
| D.步骤③中,每生成1molBr2转移2mol电子 |
(6)高锰酸钾是生活中常用的一种消毒剂,也常被用于物质成分分析。二氧化锰是制取高锰酸钾的重要原料。制取高锰酸钾的方法是先用二氧化锰制取锰酸钾(K2MnO4),再转化为高锰酸钾。反应过程如下:
i.______MnO2+________KOH+____KClO3
 ____K2MnO4+____KCl+____H2O
____K2MnO4+____KCl+____H2Oii.3K2MnO4+4HCl=2KMnO4+4KCl+2H2O+MnO2
①下列反应中二氧化锰做氧化剂的是
a.实验室用氯酸钾和二氧化锰的混合物加热制取氧气
b.实验室用二氧化锰和浓盐酸混合加热制取氯气
c.用二氧化锰和铝混合发生铝热反应制取锰
d.用二氧化锰、氢氧化钾、氯酸钾共熔制取锰酸钾(K2MnO4)
②设计实验证明二氧化锰中含有哪种类型的化学键。(写出实验步骤、现象和结论)
③配平反应i的化学方程式
④标出反应ii中电子转移的方向和数目
⑤若工业上使用纯度为87%的软锰矿(主要成分为二氧化锰)制取高锰酸钾,理论上10吨软锰矿可制取高锰酸钾
您最近一年使用:0次
名校
解题方法
2 . 下列说法有几项是正确的
①质子数相同的粒子一定属于同一种元素
②含金属元素的离子可能是阴离子
③化学键可存在于相邻的原子之间,也可存在于相邻的分子之间
④某化合物在水溶液中能导电,可以证明该化合物内一定存在离子键
⑤两种非金属元素形成AB型化合物,它一定含共价键
⑥物质中化学键被破坏,一定发生化学变化
⑦氢氟酸贮存在细口玻璃瓶里
①质子数相同的粒子一定属于同一种元素
②含金属元素的离子可能是阴离子
③化学键可存在于相邻的原子之间,也可存在于相邻的分子之间
④某化合物在水溶液中能导电,可以证明该化合物内一定存在离子键
⑤两种非金属元素形成AB型化合物,它一定含共价键
⑥物质中化学键被破坏,一定发生化学变化
⑦氢氟酸贮存在细口玻璃瓶里
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
2023-08-10更新
|
151次组卷
|
2卷引用:山东省实验中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
3 . 下图为NaCl在不同状态下的导电实验(X、Y均为石墨电极),下列说法错误的是
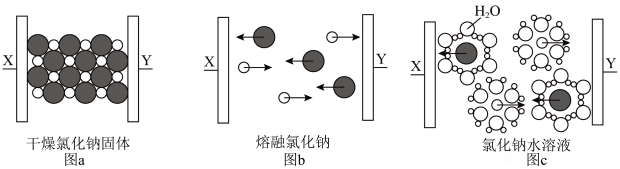

A.图示中“ ”代表的离子的电子式为 ”代表的离子的电子式为 |
| B.图a中放入的是氯化钠固体,该条件下氯化钠不导电 |
| C.图b和图c中发生的化学反应完全相同 |
| D.图b能证明氯化钠为离子化合物 |
您最近一年使用:0次
名校
4 . 下列说法中正确的是
| A.离子键就是使阴、阳离子结合成化合物的静电引力 |
B. 晶体中含共价键,是共价化合物 晶体中含共价键,是共价化合物 |
C.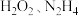 分子中只含有共价键 分子中只含有共价键 |
| D.某化合物在水溶液中能导电,可以证明该化合物内一定存在离子键 |
您最近一年使用:0次
2022-05-23更新
|
238次组卷
|
9卷引用:2015-2016学年四川省资阳市高一下学期期末化学试卷
2015-2016学年四川省资阳市高一下学期期末化学试卷四川省自贡市田家炳中学2021届高三上学期开学考试化学试题四川省成都外国语学校2020-2021学年高一下学期第三次(6月)月考化学试题(已下线)第13讲 原子结构 化学键(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)山东师范大学附属中学2021-2022学年高一下学期期中考试(等级考)化学试题浙江省舟山市普陀中学2021-2022学年高一下学期6月月考化学试题(已下线)专题五 元素周期律 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)【2022】【高二上】【期中考】【高中化学】61(已下线)第五章 物质结构与性质元素周期律 第29练 化学键 分子的空间结构
名校
解题方法
5 . 下表是某些短周期元素的电负性(x)值:
(1)根据上表试推测,元素周期表中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为___________ 。
(2)已知: 。
。
①若 最初水解产物是
最初水解产物是 和HClO,根据
和HClO,根据 的化合价推测
的化合价推测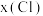 的范围是
的范围是___________ (填表中数值);
② 水解的化学反应方程式是
水解的化学反应方程式是___________ 。
(3)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(2)①进行分析, 属于
属于___________ (填“离子化合物”或“共价化合物”),可设计实验证明,如测定___________ 。
| 元素符号 | Li | Be | N | O | F | Na | Mg | Al | P | S |
| x值 | 1.0 | 1.5 | 3.0 | a | 4.0 | 0.9 | 1.2 | 1.5 | 2.1 | 2.5 |
(2)已知:
 。
。①若
 最初水解产物是
最初水解产物是 和HClO,根据
和HClO,根据 的化合价推测
的化合价推测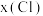 的范围是
的范围是②
 水解的化学反应方程式是
水解的化学反应方程式是(3)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(2)①进行分析,
 属于
属于
您最近一年使用:0次
解题方法
6 . 用充有NH3的烧瓶进行“喷泉实验”,装置及现象如下图。下列关于该实验的分析正确的是
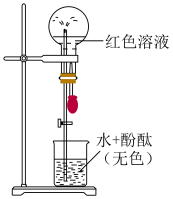
| A.产生“喷泉”证明NH3与H2O发生了反应 |
| B.无色溶液变红证明NH3极易溶于水 |
| C.红色溶液中存在含有离子键的含氮微粒 |
| D.加热红色溶液可观察到红色变浅或褪去 |
您最近一年使用:0次
名校
7 . 随原子序数递增,八种短周期元素(用字母 等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
(1)f在周期表中的位置是_______ 。
(2) 、
、 两种元素的原子可构成一种碱性物质,该物质的电子式是
两种元素的原子可构成一种碱性物质,该物质的电子式是_______ 。
(3)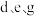 三者简单离子的半径由大到小顺序是(用离子符号表示):
三者简单离子的半径由大到小顺序是(用离子符号表示):_______ 。
(4)写出一个能证明 非金属性强弱的化学方程式:
非金属性强弱的化学方程式:_______ 。
(5) 最简单化合物的空间构型为
最简单化合物的空间构型为_______ 。
(6)下列判断不正确的是_______。
 等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。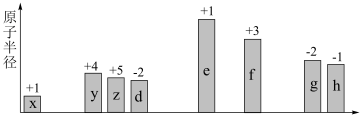
(1)f在周期表中的位置是
(2)
 、
、 两种元素的原子可构成一种碱性物质,该物质的电子式是
两种元素的原子可构成一种碱性物质,该物质的电子式是(3)
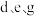 三者简单离子的半径由大到小顺序是(用离子符号表示):
三者简单离子的半径由大到小顺序是(用离子符号表示):(4)写出一个能证明
 非金属性强弱的化学方程式:
非金属性强弱的化学方程式:(5)
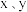 最简单化合物的空间构型为
最简单化合物的空间构型为(6)下列判断不正确的是_______。
A. 和 和 可以形成 可以形成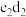 型化合物,正、负离子物质的量之比为 型化合物,正、负离子物质的量之比为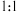 |
B.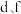 组成的化合物具有两性 组成的化合物具有两性 |
C. 的最高价氧化物对应水化物与 的最高价氧化物对应水化物与 的氢化物反应生成产物中既含有离子键又含有共价键 的氢化物反应生成产物中既含有离子键又含有共价键 |
D. 与 与 同主族,相差两个周期 同主族,相差两个周期 |
您最近一年使用:0次
名校
8 . 在研究前18号元素时发现,随原子序数递增可以将它们排成如下图所示的蜗牛形状。图中每个点代表一种元素,其中①代表氢元素。
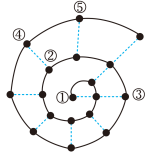
(1)元素①、②形成的化合物中所含的化学键为___________ 键(填“离子”或“共价”,下同);元素③、⑤形成的化合物属于___________ 化合物。元素⑤最高价氧化物对应的水化物化学式___________ 。
(2)Cs元素与元素③同主族,Cs单质与水反应的化学方程式为___________ 。
(3)元素④在元素周期表中位于第三周期___________ 族。
(4)约里奥-居里夫妇在核反应中用 粒子轰击
粒子轰击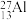 ,得到核素
,得到核素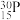 。
。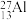 的原子结构示意图为
的原子结构示意图为___________ ,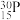 与
与 互称为
互称为___________ 。
(5)把相同大小的一块铝片和镁片分别投入相同浓度的 溶液中,铝溶解有气泡放出;而镁没有任何变化,能否证明铝的金属性比镁强
溶液中,铝溶解有气泡放出;而镁没有任何变化,能否证明铝的金属性比镁强___________ (填“能”或“不能”)。写出铝与NaOH溶液反应化学方程式___________ 。

(1)元素①、②形成的化合物中所含的化学键为
(2)Cs元素与元素③同主族,Cs单质与水反应的化学方程式为
(3)元素④在元素周期表中位于第三周期
(4)约里奥-居里夫妇在核反应中用
 粒子轰击
粒子轰击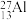 ,得到核素
,得到核素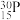 。
。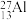 的原子结构示意图为
的原子结构示意图为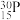 与
与 互称为
互称为(5)把相同大小的一块铝片和镁片分别投入相同浓度的
 溶液中,铝溶解有气泡放出;而镁没有任何变化,能否证明铝的金属性比镁强
溶液中,铝溶解有气泡放出;而镁没有任何变化,能否证明铝的金属性比镁强
您最近一年使用:0次
解题方法
9 . 能证明HCl是共价化合物的是
| A.水溶液呈酸性 | B.受热不易分解 |
| C.液态下不能导电 | D.仅由非金属元素组成 |
您最近一年使用:0次
解题方法
10 . 几种主族元素在周期表中的位置如下:
(1)⑤元素的最简单氢化物是________ (填化学式),①和⑦形成的化合物中存在的化学键类型为_______ ,④和⑧形成的化合物中存在的化学键类型为________ 。
(2)①③⑥三种元素原子半径由大到小的顺序是________ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的离子结构示意图为_______ ,该元素在周期表中的位置是________ 。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的物质的电子式是________ ,③的单质与其反应的离子方程式为________ 。
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是________ (填字母,下同)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑧的气态氢化物溶于水形成的酸酸性比⑦的气态氢化物溶于水形成的酸酸性强
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦氧化物对应的水化物的酸性强于⑧氧化物对应的水化物的酸性
(6)用电子式表示①的单质与⑨的单质形成化合物的过程:_______ 。
族 周期 | IA | 0 | ||||||
| 1 | ④ | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑨ | ⑦ | ||||
| 4 | ② | ⑧ | ||||||
(2)①③⑥三种元素原子半径由大到小的顺序是
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的离子结构示意图为
(4)①②③三种元素最高价氧化物对应水化物碱性最强的物质的电子式是
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是
a.⑦的氢化物比⑧的氢化物稳定
b.⑧的气态氢化物溶于水形成的酸酸性比⑦的气态氢化物溶于水形成的酸酸性强
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦氧化物对应的水化物的酸性强于⑧氧化物对应的水化物的酸性
(6)用电子式表示①的单质与⑨的单质形成化合物的过程:
您最近一年使用:0次



