1 . 已知2Li+2H2O=2LiOH+H2↑,LiH+H2O= LiOH+H2↑。Li 电池使用时产生的LiH会影响其性能,常用D2O与Li、LiH 混合物反应测定Li电池中LiH含量。下列说法正确的是
| A.Li和LiH的晶体类型相同 | B.H2O和D2O的化学性质不同 |
| C.LiOH 中既含离子键又含共价键 | D.气态产物中 越大,LiH含量越高 越大,LiH含量越高 |
您最近一年使用:0次
名校
2 . 短周期主族元素W、X、Y、Z的原子序数依次增大,X是地壳中含量最多的元素,W、Y原子的最外层电子数之比为4:3,原子最外层电子数Z比Y多4个。下列说法不正确的是
| A.元素W与氢形成的原子比为1:1的化合物有多种 |
| B.WZ4分子中所有原子最外层均满足8电子结构 |
| C.工业上通常采用电解熔融的Y2X3制备Y单质 |
| D.Z的氧化物对应水化物的酸性一定强于W氧化物对应水化物的酸性 |
您最近一年使用:0次
3 . 氮元素是空气中含量最多的元素,在自然界中的分布十分广泛,在生物体内亦有极大作用。一定条件下,含氮元素的物质可发生如图所示的循环转化。回答下列问题:
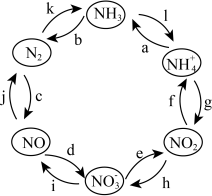
(1)氮分子的电子式为________ 。
(2)图中属于“氮的固定”的是______ (填字母)。
(3)若反应h是在NO2与H2O的作用下实现,则该反应中氧化剂与还原剂物质的量之比为_____ 。
(4)若反应i是在酸性条件下由 与Fe2+的作用实现,则该反应的离子方程式为
与Fe2+的作用实现,则该反应的离子方程式为___ 。

(1)氮分子的电子式为
(2)图中属于“氮的固定”的是
(3)若反应h是在NO2与H2O的作用下实现,则该反应中氧化剂与还原剂物质的量之比为
(4)若反应i是在酸性条件下由
 与Fe2+的作用实现,则该反应的离子方程式为
与Fe2+的作用实现,则该反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 2022年是门捷列夫发现元素周期律 153 周年,下图为元素周期表的一部分。门捷列夫预言了多种当时未知的元素,T 为其中之一、L在地壳中含量排第二位,广泛应用于信息技术等领域。
(1)写出J的原子结构示意图___________ 。
(2)下列说法不正确的是___________。
(3)已知JQ2结构中只含有极性共价键,试画出其结构式:___________ (用元素符号表示)。
(4)非金属性Q___________ M(用<、=、>来表示),判断依据是(试用一个化学方程式来表示)___________ 。
| X | Y | Z | ||
| L | J | Q | ||
| T | M |
(2)下列说法不正确的是___________。
| A.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ2 |
| B.Q、J的氧化物的水化物酸性:J<Q |
| C.用pH试纸测得Q单质的水溶液pH=3 |
| D.原子半径大小:L>J>Z |
(4)非金属性Q
您最近一年使用:0次
5 . 已知:X、Y、Z、W为原子序数依次增大的四种短周期元素,其中只有Z为金属元素,Z元素的单质与热水反应后的溶液能使酚酞试液变为浅红色,Y是地壳中含量最高的元素,X、W为同一主族元素,W元素原子的最外层电子数是次外层电子数的一半。下列判断正确的是
| A.W的最外层电子数是最内层电子数的1.5倍 |
| B.X、W最简单氢化物的沸点:X<W |
| C.化合物XY和ZY的化学键类型相同 |
| D.原子半径:r(Z)>r(W)>r(Y)>r(X) |
您最近一年使用:0次
名校
解题方法
6 . X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如表:
(1)X和W的元素符号分别为___ 、___ 。
(2)X与Y形成的原子个数比为2∶1的化合物中,Y原子最外层为8电子结构,请写出该化合物的电子式___ ,工业合成Y的氢化物的化学方程式为___ 。
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是___ 。此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为___ 。
| 元素 | 相关信息 |
| X | X的单质为密度最小的气体 |
| Y | Y的氢化物的水溶液呈碱性 |
| Z | Z是地壳中含量最高的元素 |
| W | W的一种核素的质量数为35,中子数为18 |
(2)X与Y形成的原子个数比为2∶1的化合物中,Y原子最外层为8电子结构,请写出该化合物的电子式
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是
您最近一年使用:0次
解题方法
7 . 下列有关判断的依据不正确的是
| A.吸热反应:是否要进行加热 |
| B.氧化还原反应:是否有元素化合价的变化 |
| C.化学平衡状态:平衡体系中各组分的质量分数不再改变 |
| D.离子化合物:是否含有离子键 |
您最近一年使用:0次
名校
8 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:

(1)地壳中含量居于第二位的元素在周期表中的位置是___________ 。
(2)②的最高价氧化物的分子式为___________ ;⑦的最高价氧化物对应水化物的分子式为___________ 。
(3)①、④、⑤中的某些元素可形成既含离子键又含非极性键的离子化合物,写出这种化合物的电子式:___________ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
(5)已知Cs元素位于元素周期表中第六周期第ⅠA族,请回答下列问题:
①铯的原子序数为___________ 。
②下列推断正确的是___________ (填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b与a所有可能的关系式为___________ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②的最高价氧化物的分子式为
(3)①、④、⑤中的某些元素可形成既含离子键又含非极性键的离子化合物,写出这种化合物的电子式:
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
| A.最高正化合价为+6 |
| B.气态氢化物比H2S稳定 |
| C.最高价氧化物对应水化物的酸性比硫酸弱 |
| D.单质在常温下可与氢气化合 |
①铯的原子序数为
②下列推断正确的是
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
名校
9 . 元素周期表是化学学习和化学研究的重要工具。表为元素周期表的一部分,表中①~⑩分别代表一种元素。回答下列问题:
(1)上述元素中非金属性最强的是_______ (用元素符号表示);有一种元素的氧化物和氢氧化物都是两性化合物,画出该元素的原子结构示意图_______ ;地壳中含量最多的元素在周期表中的位置是_______ 。
(2)⑦、⑧、⑨元素的离子半径由大到小的顺序为_______ (用离子符号表示)。①与⑤形成的10电子离子为_______
(3)由①、⑥、⑩组成的一种化合物有强氧化性,具有杀菌漂白的能力,则该化合物的电子式为_______ 。
(4)由⑤、⑥两元素组成的气态化合物常见的有两种,其中有一种不能用排水法收集,试用化学方程式解释原因_______ 。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
| 3 | ⑧ | ⑨ | ⑩ |
(1)上述元素中非金属性最强的是
(2)⑦、⑧、⑨元素的离子半径由大到小的顺序为
(3)由①、⑥、⑩组成的一种化合物有强氧化性,具有杀菌漂白的能力,则该化合物的电子式为
(4)由⑤、⑥两元素组成的气态化合物常见的有两种,其中有一种不能用排水法收集,试用化学方程式解释原因
您最近一年使用:0次
名校
解题方法
10 . A、B、C、D、E、F、G的原子序数依次增大的元素,A、D元素的原子最外层电子数相同,A元素的一种原子没有中子;B的一种同位素可用于考古断代;C是地壳中含量最多的一种元素;D元素的阳离子电子层结构与氖原子相同;E的最外层电子数是电子层数的2倍;F的单质具有强氧化性。G是用途最广泛的金属元素,它的单质能被磁铁所吸引;试回答以下问题:
(1)E的原子结构示意图:____ 。
(2)D单质与C单质在加热条件下反应产物的电子式____ ,该物质与A的氧化物反应产生氧气,离子方程式为_____ 。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性。则甲、乙反应的化学方程式为____ 。
(4)G单质在一定条件下可以和A2C反应,方程式为_______ 。
(5)用电子式写出A2C的形成过程_______ 。
(1)E的原子结构示意图:
(2)D单质与C单质在加热条件下反应产物的电子式
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性。则甲、乙反应的化学方程式为
(4)G单质在一定条件下可以和A2C反应,方程式为
(5)用电子式写出A2C的形成过程
您最近一年使用:0次



