解题方法
1 . 为清理高速公路上的积雪使用了一种融雪剂,其主要成分的化学式为XY2。X原子的结构示意图为 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=___ ,该融雪剂的化学式为___ 。
(2)Z、W元素的名称为___ 、___ 。
(3)下列说法正确的是___ 。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。(1)m=
(2)Z、W元素的名称为
(3)下列说法正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
您最近一年使用:0次
名校
2 . 元素周期表揭示了元素之间的内在联系,使元素构成了一个较为系统的体系.请回答下列问题:
Ⅰ.元素周期表的建立与完善是一个渐进的过程.直至20世纪初,原子结构奥秘被揭示后,元素周期表中元素的排序由依据相对原子质量改为依据原子的_______ 。按照元素在周期表中的顺序给元素编号,得到原子序数。人们发现原子序数与元素的原子结构之间存在如下关系:原子序数=_______ =核外电子数
Ⅱ.图为元素周期表的一部分,序号①~⑥分别代表周期表中相应位置的种元素。
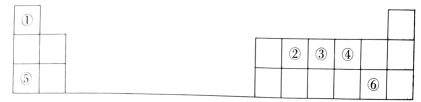
(1)②、③、④三种元素中,原子半径由大到小的顺序为_______ (用元素符号表示)。
(2)①、④、⑤三种元素形成的化合物的电子式为_______ ,该化合物中化学键的类型有_______ 。
(3)元素Q位于第四周期,且与元素⑥均为同一主族元素。请用离子方程说明⑥和Q两种元素单质氧化性的强弱:_______ 。根据元素周期律推测,下列性质中Q不可能具有的是_______ (填选项字母)。
A.最高正化合价为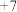 B.气态氢化物比⑥的稳定 C.单质在常温下可与氢气化合
B.气态氢化物比⑥的稳定 C.单质在常温下可与氢气化合
Ⅰ.元素周期表的建立与完善是一个渐进的过程.直至20世纪初,原子结构奥秘被揭示后,元素周期表中元素的排序由依据相对原子质量改为依据原子的
Ⅱ.图为元素周期表的一部分,序号①~⑥分别代表周期表中相应位置的种元素。

(1)②、③、④三种元素中,原子半径由大到小的顺序为
(2)①、④、⑤三种元素形成的化合物的电子式为
(3)元素Q位于第四周期,且与元素⑥均为同一主族元素。请用离子方程说明⑥和Q两种元素单质氧化性的强弱:
A.最高正化合价为
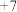 B.气态氢化物比⑥的稳定 C.单质在常温下可与氢气化合
B.气态氢化物比⑥的稳定 C.单质在常温下可与氢气化合
您最近一年使用:0次
2021-01-28更新
|
172次组卷
|
2卷引用:山西省2020-2021学年高一上学期期末考试化学试题
解题方法
3 . A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族元素原子中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)D在周期表中的位置为___ ;B的原子结构示意图为___ 。
(2)E元素形成的最高价氧化物对应水化物的化学式为___ 。
(3)元素C、D、E的原子半径大小关系是___ (用元素符号表示)。
(4)C、D可形成化合物D2C2,D2C2含有的化学键是___ 。
(1)D在周期表中的位置为
(2)E元素形成的最高价氧化物对应水化物的化学式为
(3)元素C、D、E的原子半径大小关系是
(4)C、D可形成化合物D2C2,D2C2含有的化学键是
您最近一年使用:0次
2020-12-29更新
|
112次组卷
|
2卷引用:浙江省嘉兴市海宁中学2020-2021学年高一上学期第二次月考化学试题
名校
解题方法
4 . A、B、C、D、E是原子序数依次增大的五种短周期元素。B、E同主族,且满足最高正化合价+最低负化合价=0;A与C、D与C之间都能形成原子个数之比分别为2∶1和1∶1的两种化合物。试回答下列有关问题:
(1)在A2C2分子中含有的化学键是________ 和________ 。
(2)C与D形成化合物的电子式分别为________ 、________ 。
(3)实验室可用由B、C、D组成的化合物为反应物之一制取由A、C、D组成的化合物,反应的化学方程式为________ 。
(4)写出比E原子序数小1的元素形成的单质与A、C、D形成的化合物的水溶液反应的离子方程式:________________ 。
(1)在A2C2分子中含有的化学键是
(2)C与D形成化合物的电子式分别为
(3)实验室可用由B、C、D组成的化合物为反应物之一制取由A、C、D组成的化合物,反应的化学方程式为
(4)写出比E原子序数小1的元素形成的单质与A、C、D形成的化合物的水溶液反应的离子方程式:
您最近一年使用:0次
5 . 下表是元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题.
(1)可作半导体材料的元素是 ______ (填元素符号);气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐的元素是 _____ (填名称);
(2)第三周期中离子半径最小的是___________ (填离子符号);
(3)①~⑨的最高价氧化物的水化物中:酸性最强的是__________ (填化学式);碱性最强的是________ (填化学式)。
(4)比较③、⑧最简单氢化物的稳定性:____________________ (用化学式表示)。
(5)写出②形成单质电子式________ 。
(6)⑤和⑨形成的化合物中所含化学键类型为________ 。
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)第三周期中离子半径最小的是
(3)①~⑨的最高价氧化物的水化物中:酸性最强的是
(4)比较③、⑧最简单氢化物的稳定性:
(5)写出②形成单质电子式
(6)⑤和⑨形成的化合物中所含化学键类型为
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
(1)画出D的原子结构示意图___ ,E元素在周期表中的位置是____ 。
(2)A与C形成原子个数比为1:1的化合物甲,其中含有化学键类型为____ 。
(3)D与C按原子个数比为1:1形成化合物的电子式是____ 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是____ (填化学式)。
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与C形成的化合物甲反应的离子方程式____ 。
(6)E(s)+O2(g)=EO2(g)ΔH1;E(g)+O2(g)=EO2(g) ΔH2,则ΔHl____ ΔH2(填“>”或“<”或“=”)。
(1)画出D的原子结构示意图
(2)A与C形成原子个数比为1:1的化合物甲,其中含有化学键类型为
(3)D与C按原子个数比为1:1形成化合物的电子式是
(4)B、C所形成氢化物的稳定性由强到弱的顺序是
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与C形成的化合物甲反应的离子方程式
(6)E(s)+O2(g)=EO2(g)ΔH1;E(g)+O2(g)=EO2(g) ΔH2,则ΔHl
您最近一年使用:0次
7 . A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的﹣1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题:
(1)B元素在元素周期表中的位置是______________ ;
(2)画出C元素的原子结构示意图______ ;
(3)与E的氢化物分子所含电子总数相等的分子是______ (举一例,填化学式,);
(4)A与D形成的化合物中含有化学键的类型是_____ 。
(1)B元素在元素周期表中的位置是
(2)画出C元素的原子结构示意图
(3)与E的氢化物分子所含电子总数相等的分子是
(4)A与D形成的化合物中含有化学键的类型是
您最近一年使用:0次
名校
解题方法
8 . 在遭遇冰雪灾害时,常使用一种融雪剂其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子。
(1)该融雪剂的化学式是___ ,电子式是___ ,该物质中化学键类型是__ 。
(2)主族元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图___ ;是D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的电子式为___ ,化学键类型为___ (填“离子键”或“共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成___ ,其化学键类型为___ ;加热时生成___ ,其化学键类型为____ ,电子式为___ 。
(1)该融雪剂的化学式是
(2)主族元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成
您最近一年使用:0次
2020-10-10更新
|
431次组卷
|
9卷引用:人教版2017-2018学年高一化学必修二同步训练:第一章 物质结构 元素周期律
人教版2017-2018学年高一化学必修二同步训练:第一章 物质结构 元素周期律北京市人大附中2017-2018学年下学期高一第一次月考 化学试卷山西省祁县中学2017-2018学年高一下学期第一次月考化学试题人教版(2019)高一必修第一册 第四章 物质结构 元素周期律 第三节 化学键高一必修第一册(苏教2019)专题5 第二单元 微粒之间的相互作用力2(已下线)4.3.1 离子键(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)黑龙江省讷河市拉哈一中2020-2021学年高一下学期3月月考化学试题内蒙古通辽市科左后旗甘旗卡第二高级中学2020-2021学年高一上学期期末化学试题(已下线)易错专题29 化学键-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)
名校
解题方法
9 . 下表是元素周期表的一-部分,其中每个数字序号代表一种短周期元素。根据表中所列①~⑩元素,请按要求回答下列问题:
(1)元素①形成的最高价氧化物的电子式为____ ,⑤⑨两种元素形成的化合物的电子式为___ ,①~⑩元素的最高价氧化物的水化物酸性最强的是____ (填化学式)。
(2)由③④⑩三种元素组成的离子化合物中所含有的化学键有_____ 。
(3)①的单质与②的最高价氧化物的水化物的浓溶液反应的化学方程式为______ 。
(4)下列事实能说明③非金属性比⑧强的有_____ 。
a.③的单质与⑧的氢化物溶液反应,溶液变浑浊
b.③⑧形成简单离子时,得电子数目的多少
c.③与⑧两元素的简单氢化物受热分解,前者的分解温度高
d.③与⑧两元素的简单氢化物的沸点,前者高
⑩ | |||||||||||||||||
① | ② | ③ | |||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)由③④⑩三种元素组成的离子化合物中所含有的化学键有
(3)①的单质与②的最高价氧化物的水化物的浓溶液反应的化学方程式为
(4)下列事实能说明③非金属性比⑧强的有
a.③的单质与⑧的氢化物溶液反应,溶液变浑浊
b.③⑧形成简单离子时,得电子数目的多少
c.③与⑧两元素的简单氢化物受热分解,前者的分解温度高
d.③与⑧两元素的简单氢化物的沸点,前者高
您最近一年使用:0次
名校
10 . 随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是__ 。
(2)比较d、e常见离子的半径大小(用化学式表示,下同)_ >__ ;比较g、h的最高价氧化物对应的水化物的酸性强弱是:__ >__ 。
(3)画出x2d2的电子式:__ 。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是
(2)比较d、e常见离子的半径大小(用化学式表示,下同)
(3)画出x2d2的电子式:
您最近一年使用:0次



