名校
解题方法
1 . A、B、C、D、E是原子序数依次增大并分属四个周期的前20号主族元素。B、C相邻且C原子的最外层电子数是内层电子数的3倍,D、E能形成化合物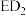 。
。
(1)B在元素周期表中的位置是___________ ,化合物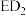 的电子式为
的电子式为___________ 。
(2)A与B、C形成的简单化合物的稳定性相对强弱为___________ (用化学式表示);化合物 中的化学键类型为
中的化学键类型为___________ 。
(3)科学研究发现化合物BC具有“扩张血管和增强免疫力、记忆力”的功能,故它成为当前生命科学研究中的“明星分子”。一定条件下该“明星分子”可转化为化合物B,C与另一种常见的红棕色气体,写出反应的化学方程式:___________ ,同温同体积条件下,该反应完全转化后,容器内反应前后的压强比为___________ 。
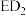 。
。(1)B在元素周期表中的位置是
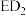 的电子式为
的电子式为(2)A与B、C形成的简单化合物的稳定性相对强弱为
 中的化学键类型为
中的化学键类型为(3)科学研究发现化合物BC具有“扩张血管和增强免疫力、记忆力”的功能,故它成为当前生命科学研究中的“明星分子”。一定条件下该“明星分子”可转化为化合物B,C与另一种常见的红棕色气体,写出反应的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 物质世界丰富多彩,原子间通过化学键构成了各种各样的物质。请根据下列物质,完成填空。
A.干冰 B.二氧化硅 C.冰 D.金刚石 E.溴化钠 F.氯化钠 G.氢氧化钠 H.固体碘 I.硫酸铵
(1)熔化时不需要破坏化学键的是_______ ,由原子直接构成的晶体是_______ ,晶体中既有离子键,又有共价键的是_______ (用字母序号填空)。
(2)E、F两种晶体的熔点:E_______ F(填“>”或“<”),请说明理由_______ 。
(3)氯化钠的电子式为_______ ,用电子式表示碘分子的形成过程_______ 。
(4)CO2分子的结构式为_______ ,22g干冰中含有_______ molC=O键。
(5)科学家在高压下成功将CO2转化为具有类似SiO2结构的共价晶体。在该转化过程中_______ (填“有”或“无”)化学键的变化,CO2分子晶体和CO2共价晶体物理性质_______ (填“相同”或“不同”),CO2共价晶体中每个碳原子以共价单键与相邻_______ 个氧原子成键。
A.干冰 B.二氧化硅 C.冰 D.金刚石 E.溴化钠 F.氯化钠 G.氢氧化钠 H.固体碘 I.硫酸铵
(1)熔化时不需要破坏化学键的是
(2)E、F两种晶体的熔点:E
(3)氯化钠的电子式为
(4)CO2分子的结构式为
(5)科学家在高压下成功将CO2转化为具有类似SiO2结构的共价晶体。在该转化过程中
您最近一年使用:0次
名校
3 . A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大。A与C同主族,可形成CA型离子化合物,D是同周期元素中简单离子半径最小的元素,B与E同主族,E2-与Ar原子具有相同的电子层结构,W的合金用量最大、用途最广。回答下列问题:
(1)C在元素周期表中的位置是___________ 。
(2)A分别与B、E形成的最简单化合物中沸点较高的是______ (填化学式),原因是___________ 。
(3)A、B、C三种元素形成的物质中含有的化学键类型是______ 。
(4)D单质与C的最高价氧化物对应水化物的溶液反应,反应的化学方程式为___________ 。
(5)向盛有A2B2溶液的试管中加入几滴酸化的WEB4溶液,溶液变成棕黄色,发生反应的离子方程式为___________ 。
(1)C在元素周期表中的位置是
(2)A分别与B、E形成的最简单化合物中沸点较高的是
(3)A、B、C三种元素形成的物质中含有的化学键类型是
(4)D单质与C的最高价氧化物对应水化物的溶液反应,反应的化学方程式为
(5)向盛有A2B2溶液的试管中加入几滴酸化的WEB4溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 现有部分短周期元素的性质或原子结构如表:
(1)元素X在元素周期表中的位置为________ 。
(2)元素Y与氢元素形成离子YH 的电子式为
的电子式为______ 。
(3)下列表述中能证明元素X、元素Y非金属性强弱的是_____ 。
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物对应水化物的酸性比X的最高价氧化物对应水化物的酸性强
c.X与Y形成的化合物中X元素呈正价状态
(4)Y的最高价氧化物的水化物与气态氢化物合成的化合物含的化学键类型是_______ 。
(5)写出实验室制取Y的最简单氢化物的化学方程式:________ 。
(6)在100mL 18 mol∙L−1的浓硫酸中加入过量的铜片,加热使之充分反应,若使剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式_______ 。
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
(2)元素Y与氢元素形成离子YH
 的电子式为
的电子式为(3)下列表述中能证明元素X、元素Y非金属性强弱的是
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物对应水化物的酸性比X的最高价氧化物对应水化物的酸性强
c.X与Y形成的化合物中X元素呈正价状态
(4)Y的最高价氧化物的水化物与气态氢化物合成的化合物含的化学键类型是
(5)写出实验室制取Y的最简单氢化物的化学方程式:
(6)在100mL 18 mol∙L−1的浓硫酸中加入过量的铜片,加热使之充分反应,若使剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式
您最近一年使用:0次
名校
解题方法
5 . 下表列出了①~⑥六种元素在元素周期表中的位置:
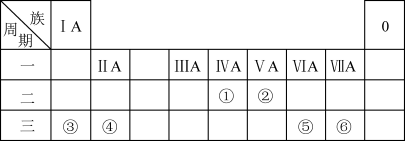
请按要求回答下列问题:
(1)元素②的单质的电子式是___________ 。
(2)元素⑤与⑥的简单气态氢化物的热稳定性比较:___________ (填化学式)。
(3)这六种元素中,位于第三周期且原子半径最小的元素的原子结构示意图为___________ 。
(4)这六种元素中,能与氧结合,生成物可做耐火材料的是___________ (填元素符号)。
(5)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为___________ ;向上述反应后的溶液中再通入元素⑥的单质,发生反应的化学方程式为___________ 。

请按要求回答下列问题:
(1)元素②的单质的电子式是
(2)元素⑤与⑥的简单气态氢化物的热稳定性比较:
(3)这六种元素中,位于第三周期且原子半径最小的元素的原子结构示意图为
(4)这六种元素中,能与氧结合,生成物可做耐火材料的是
(5)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为
您最近一年使用:0次
6 . 随着原子序数的递增,A~G七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。
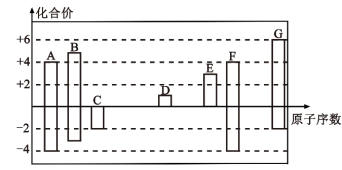
(1)G元素在周期表中的位置为___________ 。
(2)元素A与C形成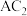 分子的电子式为
分子的电子式为____ ,B元素的单质的结构式为___________ 。
(3)A、B、F三种元素的原子半径由大到小的顺序是____ 。(填元素符号)
(4)D元素最高价氧化物的水化物所含的化学键有___________ (填化学键类型),D元素最高价氧化物的水化物与E元素的最高价氧化物的水化物反应的离子方程式是___________ 。
(5)元素C、G形成的简单气态氢化物中,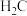 与
与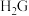 的稳定性较强的是
的稳定性较强的是___________ (填化学式)。
(6)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷(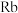 )是37号元素,相对原子质量是85,位于ⅠA族。关于铷的下列说法中不正确的是___________(填序号)。
)是37号元素,相对原子质量是85,位于ⅠA族。关于铷的下列说法中不正确的是___________(填序号)。

(1)G元素在周期表中的位置为
(2)元素A与C形成
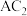 分子的电子式为
分子的电子式为(3)A、B、F三种元素的原子半径由大到小的顺序是
(4)D元素最高价氧化物的水化物所含的化学键有
(5)元素C、G形成的简单气态氢化物中,
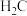 与
与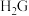 的稳定性较强的是
的稳定性较强的是(6)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷(
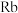 )是37号元素,相对原子质量是85,位于ⅠA族。关于铷的下列说法中不正确的是___________(填序号)。
)是37号元素,相对原子质量是85,位于ⅠA族。关于铷的下列说法中不正确的是___________(填序号)。| A.与水反应比钠更剧烈 | B.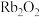 与水能剧烈反应并释放出 与水能剧烈反应并释放出 |
C.单质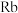 具有很强的氧化性 具有很强的氧化性 | D.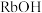 的碱性比同浓度的 的碱性比同浓度的 弱 弱 |
您最近一年使用:0次
解题方法
7 . 2022年是门捷列夫发现元素周期律 153 周年,下图为元素周期表的一部分。门捷列夫预言了多种当时未知的元素,T 为其中之一、L在地壳中含量排第二位,广泛应用于信息技术等领域。
(1)写出J的原子结构示意图___________ 。
(2)下列说法不正确的是___________。
(3)已知JQ2结构中只含有极性共价键,试画出其结构式:___________ (用元素符号表示)。
(4)非金属性Q___________ M(用<、=、>来表示),判断依据是(试用一个化学方程式来表示)___________ 。
| X | Y | Z | ||
| L | J | Q | ||
| T | M |
(2)下列说法不正确的是___________。
| A.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ2 |
| B.Q、J的氧化物的水化物酸性:J<Q |
| C.用pH试纸测得Q单质的水溶液pH=3 |
| D.原子半径大小:L>J>Z |
(4)非金属性Q
您最近一年使用:0次
8 . A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处于同一周期,A 的最外层电子数是次外层电子数的2倍,A、C处于同一主族。C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题。
(1)元素分别是:A_______ ,D_______ (填元素名称)。
(2)A、B2种元素分别形成的气态氢化物的稳定性由小到大的顺序是_______ 。(填化学式)
(3)A与B形成的三原子分子的电子式是_______ 。组成的化合物属于_______ (填“离子化合物”或“共价化合物”),B与D形成的原子个数之比为1∶1的化合物的电子式是_______ ,含有的化学键是_______ 和_______ 。
(4)用电子式表示化合物D2B的形成过程_______ 。
(1)元素分别是:A
(2)A、B2种元素分别形成的气态氢化物的稳定性由小到大的顺序是
(3)A与B形成的三原子分子的电子式是
(4)用电子式表示化合物D2B的形成过程
您最近一年使用:0次
名校
解题方法
9 . 氢气和核能是可以开发利用的新能源。
(1)氢气是未来最具有前途的能源之一。氢气能将二氧化碳转化为CH3OH等液体燃料。以H2、CO2为原料制CH3OH涉及的主要反应如下:
ⅰ.H2(g)+CO2(g) CO(g)+H2O(g) ∆H1=+41kJ·mol-1
CO(g)+H2O(g) ∆H1=+41kJ·mol-1
ⅱ.CO(g)+2H2(g) CH3OH(g) ∆H2=-90kJ·mol-1
CH3OH(g) ∆H2=-90kJ·mol-1
①CO2分子中含有___________ 键(填“极性”或“非极性”)。
②H2(g)、CO2(g)转化为CH3OH(g)、H2O(g)的热化学方程式为___________ 。
(2)开发利用核能可以减少对化石能源的依赖。UO2是一种常用的核燃料,该核燃料的一种制备流程如下:
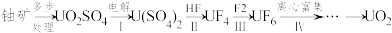
I中,将含有硫酸的UO2SO4溶液通入电解槽,如图所示。

①A电极是___________ (填“阴极”或“阳极”),其电极反应式是___________ 。
②B电极的电极反应式___________ 。
③U4+有较强的还原性。用质子交换膜隔开两极区溶液可以___________ ,从而提高U4+的产率。
(1)氢气是未来最具有前途的能源之一。氢气能将二氧化碳转化为CH3OH等液体燃料。以H2、CO2为原料制CH3OH涉及的主要反应如下:
ⅰ.H2(g)+CO2(g)
 CO(g)+H2O(g) ∆H1=+41kJ·mol-1
CO(g)+H2O(g) ∆H1=+41kJ·mol-1ⅱ.CO(g)+2H2(g)
 CH3OH(g) ∆H2=-90kJ·mol-1
CH3OH(g) ∆H2=-90kJ·mol-1①CO2分子中含有
②H2(g)、CO2(g)转化为CH3OH(g)、H2O(g)的热化学方程式为
(2)开发利用核能可以减少对化石能源的依赖。UO2是一种常用的核燃料,该核燃料的一种制备流程如下:
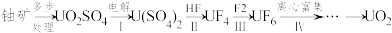
I中,将含有硫酸的UO2SO4溶液通入电解槽,如图所示。

①A电极是
②B电极的电极反应式
③U4+有较强的还原性。用质子交换膜隔开两极区溶液可以
您最近一年使用:0次
解题方法
10 . 元素周期表前四周期的元素a、b、c、d、e的原子序数依次增大,其中a、b、c、d四种元素为短周期主族元素。a的核外电子总数与其周期序数相同,b与c同周期,c与d同族,且ba3能与abc3化合生成一种可溶性盐,该盐溶液与生石灰反应生成的气体能使湿润的红色石蕊试纸变蓝。edc4为波尔多液的主要成分之一。
回答下列问题:
(1)元素e为___________ (填元素符号),a2c的电子式为___________ 。
(2)元素a、b、c、d四种元素的简单离子半径由大到小的顺序为___________ (填离子符号)。
(3)元素a和d所形成的常见化合物的分子式为___________ ,存在的化学键类型为___________ 。
(4)写出等物质的量的bc2、dc2及足量的c2同时通入a2c中发生反应生成a2dc4和abc3的化学方程式:___________ 。
(5)单质e加入由a2c2和稀a2dc4组成的混合溶液中,溶液由无色变成蓝色,写出发生反应的离子方程式:___________ 。
回答下列问题:
(1)元素e为
(2)元素a、b、c、d四种元素的简单离子半径由大到小的顺序为
(3)元素a和d所形成的常见化合物的分子式为
(4)写出等物质的量的bc2、dc2及足量的c2同时通入a2c中发生反应生成a2dc4和abc3的化学方程式:
(5)单质e加入由a2c2和稀a2dc4组成的混合溶液中,溶液由无色变成蓝色,写出发生反应的离子方程式:
您最近一年使用:0次
2021-10-19更新
|
126次组卷
|
2卷引用:山东省德州市夏津第一中学2022届高三第一次备考监测联合考试化学试卷



