2022高三·全国·专题练习
解题方法
1 . 填空。
(1)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为_______ ,微粒间存在的作用力是_______ ,SiC和晶体Si的熔、沸点高低顺序是_______ 。
(2)氧化物MO的电子总数与SiC的相等,则M为_______ (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是_______ 。
(3)C、Si为同一主族的元素,CO2和SiO2的化学式相似,但结构和性质有很大的不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成π键。从原子半径大小的角度分析,C、O原子间能形成π键,而Si、O原子间不能形成π键的原因是____ 。SiO2属于___ 晶体,CO2属于_____ 晶体,所以熔点:CO2_______ SiO2(填“<”“=”或“>”)。
(4)金刚石、晶体硅、二氧化硅、CO2 4种晶体的构成微粒种类分别是_______ ,熔化时克服的微粒间的作用力分别是_______ 。
(1)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(2)氧化物MO的电子总数与SiC的相等,则M为
(3)C、Si为同一主族的元素,CO2和SiO2的化学式相似,但结构和性质有很大的不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成π键。从原子半径大小的角度分析,C、O原子间能形成π键,而Si、O原子间不能形成π键的原因是
(4)金刚石、晶体硅、二氧化硅、CO2 4种晶体的构成微粒种类分别是
您最近一年使用:0次
名校
2 . I.下面是同学们熟悉的微粒,完成下列问题:
①N2H4②HBrO ③BaCl2④Ne ⑤NH4Cl ⑥Na2O2⑦N2
(1)这些物质中,只含有离子键的是____ ;(填序号,下同);属于共价化合物的是____ ;属于电解质的是____ 。
(2)①的结构式是____ ;用电子式表示NH3的形成____ 。
(3)在下列变化中,①液溴的挥发②烧碱熔化③H2S溶于水④Na2O2溶于水,破坏了化学键的是____ 。
II..表中的实线表示元素周期表的部分边界。____ 。
(5)某主族元素原子的核外电子排布为: ,该元素在元素周期表中的位置
,该元素在元素周期表中的位置____ 。
(6)元素I的非金属性____ (填“强于”或“弱于”)元素H,用原子结构的观点解释原因:同周期元素随着原子序数的递增,____ 。
(7)处于周期表中对角线位置(左上方和右下方)的元素,其性质具有相似性,称为“对角线规则”,元素D与F的单质及其化合物性质相似,如D、DO、D(OH)2与NaOH溶液都能反应生成Na2DO2等物质,写出D(OH)2与氢氧化钠溶液反应的化学方程式____ 。
(8)元素G的一种含氧酸化学式为:H3GO3,其结构式可表示为: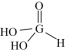 ,H3GO3分子中G原子
,H3GO3分子中G原子____ (填“是”或“不”)满足8电子稳定结构;H3GO3与过量氢氧化钠溶液反应生成的产物Na2HGO3为____ (填“酸式盐”或“正盐”)。
①N2H4②HBrO ③BaCl2④Ne ⑤NH4Cl ⑥Na2O2⑦N2
(1)这些物质中,只含有离子键的是
(2)①的结构式是
(3)在下列变化中,①液溴的挥发②烧碱熔化③H2S溶于水④Na2O2溶于水,破坏了化学键的是
II..表中的实线表示元素周期表的部分边界。
(5)某主族元素原子的核外电子排布为:
 ,该元素在元素周期表中的位置
,该元素在元素周期表中的位置(6)元素I的非金属性
(7)处于周期表中对角线位置(左上方和右下方)的元素,其性质具有相似性,称为“对角线规则”,元素D与F的单质及其化合物性质相似,如D、DO、D(OH)2与NaOH溶液都能反应生成Na2DO2等物质,写出D(OH)2与氢氧化钠溶液反应的化学方程式
(8)元素G的一种含氧酸化学式为:H3GO3,其结构式可表示为:
 ,H3GO3分子中G原子
,H3GO3分子中G原子
您最近一年使用:0次
2022-09-08更新
|
151次组卷
|
2卷引用:四川省内江市第六中学2022---2023学年高二上学期入学考试化学试题
3 . 表中是元素周期表的一部分,列出了①~⑪号元素,请用化学用语回答下列问题。
(1)①-⑨元素中,金属性最强的是____ ,其某种氧化物可用于呼吸面具中氧气来源,请写出该氧化物与二氧化碳反应的化学方程式____ 。
(2)上述元素的最高价氧化物对应的水化物中呈两性的氢氧化物是____ 。
(3)元素②的简单氢化物的电子式为____ ;②的简单氢化物与其最高价含氧酸反应的产物化学键为____ 。
(4)⑨和⑪简单氢化物的稳定性较强的是____ (填化学式)。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ | ⑪ |
(2)上述元素的最高价氧化物对应的水化物中呈两性的氢氧化物是
(3)元素②的简单氢化物的电子式为
(4)⑨和⑪简单氢化物的稳定性较强的是
您最近一年使用:0次
解题方法
4 . 几种主族元素(过渡元素略去)在周期表中的位置如图:

(1)A的元素符号是_____ 。
(2)D在周期表中的位置是____ 。
(3)E、G、T的原子半径由大到小的顺序是_____ (填元素符号)。
(4)硒元素(34Se)与D同主族,其非金属性比D_____ (填“强”或“弱”)。
(5)R元素的原子结构示意图为____ 。
(6)E、D两元素能形成原子个数比2:1和1:1的两种化合物。2:1型化合物的电子式为_____ 。1:1型化合物的化学式所含化学键类型____ 。

(1)A的元素符号是
(2)D在周期表中的位置是
(3)E、G、T的原子半径由大到小的顺序是
(4)硒元素(34Se)与D同主族,其非金属性比D
(5)R元素的原子结构示意图为
(6)E、D两元素能形成原子个数比2:1和1:1的两种化合物。2:1型化合物的电子式为
您最近一年使用:0次
解题方法
5 . 研究人员发现,在一定的实验条件下,给水施加一个弱电场,在20℃、1个大气压下,水可以结成冰,称为“热冰”。
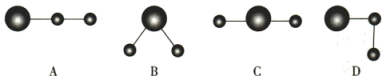
(1) 中半径较大的是
中半径较大的是_______ 原子,其原子结构示意图为_______ ;水分子中氢、氧原子间的化学键是_______ (填“共价键”或“离子键”)。
(2)用球棍模型表示的水分子结构正确的是_______ (填字母)。
(1)
 中半径较大的是
中半径较大的是(2)用球棍模型表示的水分子结构正确的是

您最近一年使用:0次
名校
解题方法
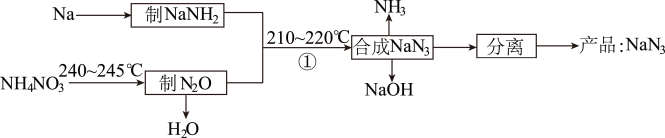
6 . NaN3是一种易溶于水(NaN3=Na++N )的白色固体,可用于有机合成和汽车安全气囊的产气药等,钠法(液氨法)制备NaN3的工艺流程如图:
)的白色固体,可用于有机合成和汽车安全气囊的产气药等,钠法(液氨法)制备NaN3的工艺流程如图:
(1)钠元素位于周期表第____ 周期第____ 族。
(2)NH3的结构式为____ ,NaOH的电子式为____ 。
(3)NaNH2中氮元素的化合价为____ ,Na+的结构示意图为_____ 。
(4)NaN3中含有的化学键类型为____ 。
(5)Na、N、O三种元素形成的简单离子半径由大到小顺序为____ 。
(6)反应NH4NO3 N2O↑+2H2O↑中,每生成1molN2O转移电子的物质的量为
N2O↑+2H2O↑中,每生成1molN2O转移电子的物质的量为_____ mol。
 )的白色固体,可用于有机合成和汽车安全气囊的产气药等,钠法(液氨法)制备NaN3的工艺流程如图:
)的白色固体,可用于有机合成和汽车安全气囊的产气药等,钠法(液氨法)制备NaN3的工艺流程如图:
(1)钠元素位于周期表第
(2)NH3的结构式为
(3)NaNH2中氮元素的化合价为
(4)NaN3中含有的化学键类型为
(5)Na、N、O三种元素形成的简单离子半径由大到小顺序为
(6)反应NH4NO3
 N2O↑+2H2O↑中,每生成1molN2O转移电子的物质的量为
N2O↑+2H2O↑中,每生成1molN2O转移电子的物质的量为
您最近一年使用:0次
7 . 下表为元素周期表的一部分,针对表中①~⑧元素,回答下列问题
(1)写出⑧的原子结构示意图_______ 。
(2)③元素在周期表中的位置是第二周期第_______ 族。
(3)写出②的最高价氧化物的电子式_______ 。
(4)⑤和⑥两种元素的最高价氧化物对应水化物中碱性较强的是_______ (填化学式)。
(5)⑤的单质在③中燃烧,产物所含化学键的类型_______ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ |
(2)③元素在周期表中的位置是第二周期第
(3)写出②的最高价氧化物的电子式
(4)⑤和⑥两种元素的最高价氧化物对应水化物中碱性较强的是
(5)⑤的单质在③中燃烧,产物所含化学键的类型
您最近一年使用:0次
名校
8 . 元素周期律、表是我们研究、预测物质性质的重要工具。
I.新版化学元素周期表中113号、115号、117号、118号等新发现元素的英文及中文命名均已确定,七个周期已全部填满。
(1)第7周期元素在结构上的共同点是____ 。
(2)113号元素位于周期表第IIIA族,其最外层电子数是___ ,写出第3周期IIIA族元素的元素符号____ 。
II.如图为部分元素周期表示意图,根据该图回答问题:
(3)X最高价氧化物的电子式是____ 。
(4)Y的最高价氧化物对应的水化物的化学式是____ 。
(5)用电子式表示氯化钠的形成过程_____ 。
(6)Ga(镓)在周期表中的位置____ ,预测氢氧化镓是两性氢氧化物,已知:氢氧化镓难溶于水,请写出氢氧化镓与氢氧化钠溶液反应的离子方程式____ 。
I.新版化学元素周期表中113号、115号、117号、118号等新发现元素的英文及中文命名均已确定,七个周期已全部填满。
(1)第7周期元素在结构上的共同点是
(2)113号元素位于周期表第IIIA族,其最外层电子数是
II.如图为部分元素周期表示意图,根据该图回答问题:
| X | ||||
| Y | Cl | |||
| Ga | 锗 | Br | ||
| I |
(4)Y的最高价氧化物对应的水化物的化学式是
(5)用电子式表示氯化钠的形成过程
(6)Ga(镓)在周期表中的位置
您最近一年使用:0次
解题方法
9 . 下表是元素周期表的一部分,根据表中给出10种元素,按要求作答。
(1)光导纤维的主要成分是_______ (填化学式)。
(2)形成化合物种类最多的元素_______ (填元素符号)。
(3)③、⑧、⑨的氢化物稳定性最强的是_______ (填化学式)。
(4)元素④、⑥的最高价氧化物对应的水化物之间可以相互反应,写出该反应的离子方程式___ 。
(5)元素②和⑤形成的化合物中含有_______ (填“离子键”或“共价键”)
(6)画出⑩的原子结构示意图_______ 。
(7)高温下,⑥单质与氧化铁反应的化学方程式为_______ ,该反应可用于_______ (填用途)。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)形成化合物种类最多的元素
(3)③、⑧、⑨的氢化物稳定性最强的是
(4)元素④、⑥的最高价氧化物对应的水化物之间可以相互反应,写出该反应的离子方程式
(5)元素②和⑤形成的化合物中含有
(6)画出⑩的原子结构示意图
(7)高温下,⑥单质与氧化铁反应的化学方程式为
您最近一年使用:0次
2022-05-20更新
|
77次组卷
|
2卷引用:福建省三明市四地四校2021-2022学年高一下学期期中联考化学试题
名校
10 .  在光照条件下与
在光照条件下与 反应,可得到各种氯代甲烷。
反应,可得到各种氯代甲烷。
(1)在甲烷分子中,碳原子以最外层的4个电子分别与氢原子形成4个_______ 键。
(2)生成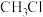 的化学方程式是
的化学方程式是_______ 。
(3)① 氯代的反应机理为自由基(带有单电子的原子或原子团,如
氯代的反应机理为自由基(带有单电子的原子或原子团,如 、
、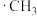 )反应,包括以下几步:
)反应,包括以下几步:
由 生成
生成 过程中,链传递其中一个方程式是
过程中,链传递其中一个方程式是 ,写出另一个方程式:
,写出另一个方程式:_______ 。
②探究光照对 与
与 反应的影响,实验如下:
反应的影响,实验如下:
a.由B和D得出的结论是_______ 。
b.依据上述反应机理,解释C中没有氯代甲烷的原因:_______ 。
 在光照条件下与
在光照条件下与 反应,可得到各种氯代甲烷。
反应,可得到各种氯代甲烷。(1)在甲烷分子中,碳原子以最外层的4个电子分别与氢原子形成4个
(2)生成
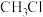 的化学方程式是
的化学方程式是(3)①
 氯代的反应机理为自由基(带有单电子的原子或原子团,如
氯代的反应机理为自由基(带有单电子的原子或原子团,如 、
、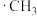 )反应,包括以下几步:
)反应,包括以下几步:| Ⅰ链引发 | Ⅱ链传递 | Ⅲ链终止 |
 | 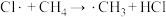 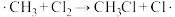 …… |   …… |
 生成
生成 过程中,链传递其中一个方程式是
过程中,链传递其中一个方程式是 ,写出另一个方程式:
,写出另一个方程式:②探究光照对
 与
与 反应的影响,实验如下:
反应的影响,实验如下:| 编号 | 操作 | 结果 |
| A | 将 与 与 混合后,光照 混合后,光照 | 得到氯代甲烷 |
| B | 将 先用光照,然后迅速在黑暗中与 先用光照,然后迅速在黑暗中与 混合 混合 | 得到氯代甲烷 |
| C | 将 先用光照,然后在黑暗中放置一段时间,再与 先用光照,然后在黑暗中放置一段时间,再与 混合 混合 | 几乎无氯代甲烷 |
| D | 将 先用光照,然后迅速在黑暗中与 先用光照,然后迅速在黑暗中与 混合 混合 | 几乎无氯代甲烷 |
b.依据上述反应机理,解释C中没有氯代甲烷的原因:
您最近一年使用:0次



