解题方法
1 . 下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白(涉及表中元素一律用对应化学符号表示):
(1)在这些元素中,化学性质最不活泼的是:_____________ (填具体元素符号,下同),原子结构示意图为_____________ 。元素⑩名称为_____________ ,在周期表中的位置_________________ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是_________________ ,碱性最强的化合物的电子式是:_________________________ 。
(3)用电子式表示元素②的常见单质_____________ 其结构式为_________________ 。
(4)表示①与⑦的化合物的电子式为_________________ ,该化合物是由_____________ (填“极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的简单离子,离子半径由大到小的顺序是_________ 。
(6)元素③的简单氢化物的结构式为_____________________ ;该氢化物常温下和元素⑦的单质反应的化学方程式为 _____________________ 。
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
(3)用电子式表示元素②的常见单质
(4)表示①与⑦的化合物的电子式为
(5)③、⑥、⑦三种元素形成的简单离子,离子半径由大到小的顺序是
(6)元素③的简单氢化物的结构式为
您最近一年使用:0次
名校
解题方法
2 . X、Y、Z、P、Q是原子序数依次增大的短周期主族元素,其中X的一种核素没有中子,Y的单质是空气的主要成分,Z和Q同主族且Q的原子序数是Z的二倍,在短周期元素中P的金属性最强。回答下列问题:
(1)X、Y、Z三种元素的原子半径从大到小的顺序为_______ (用元素符号表示)。
(2)Y、Z的简单氢化物中较不稳定的是_______ (填化学式),P和Q的最高价氧化物对应水化物的化学方程式为_______ 。
(3)M是由X、Z两种元素组成的含有10个电子的分子,M的电子式为_______ ,M分解反应过程中,反应物中化学键断裂吸收的总能量_______ 生成物中化学键形成放出的能量(填“大于”、“小于”或“等于”)。
(4)已知化合物PX与水反应生成氢气,因此可将其用作野外生存的生氢剂。
①该反应的化学方程式为_______ 。
②该反应中的氧化剂是_______ 还原剂是_______ 。
③反应中涉及到化学键的断裂和形成,其中包括_______ 填序号)。
a.离子键 b.极性共价键 c.非极性共价键 d.氢键
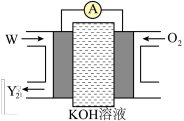
(5)化合物W是由X、Y两种元素组成的含有18个电子的分子,是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料,一种W燃料电池的工作原理如下图所示。放电一段时间,电解质溶液中OH﹣的物质的量浓度_______ (填“增大”“减小”或“不变”),负极反应式为_______ 。
(1)X、Y、Z三种元素的原子半径从大到小的顺序为
(2)Y、Z的简单氢化物中较不稳定的是
(3)M是由X、Z两种元素组成的含有10个电子的分子,M的电子式为
(4)已知化合物PX与水反应生成氢气,因此可将其用作野外生存的生氢剂。
①该反应的化学方程式为
②该反应中的氧化剂是
③反应中涉及到化学键的断裂和形成,其中包括
a.离子键 b.极性共价键 c.非极性共价键 d.氢键
(5)化合物W是由X、Y两种元素组成的含有18个电子的分子,是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料,一种W燃料电池的工作原理如下图所示。放电一段时间,电解质溶液中OH﹣的物质的量浓度
您最近一年使用:0次
名校
解题方法
3 . 下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素,用化学用语回答下列问题:
(1)⑤在元素周期表中的位置是__________ 。
(2)①的最高价氧化物的结构式为___________ 。
(3)②③单质在加热条件下形成的物质中含有的化学键类型是__________ 。
(4)用电子式表示④⑦元素物质的形成过程__________ 。
(5)②、④、⑥离子半径由大到小的顺序为____________ 。
(6)②⑦组成的物质是新的自来水消毒剂,可以用来除去水中超标的锰离子,生成黑色沉淀,当消耗13.50g②⑦组成的物质时,共转移了1mol电子,则反应的离子方程式为____________ 。
① | ② | |||||||
③ | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)①的最高价氧化物的结构式为
(3)②③单质在加热条件下形成的物质中含有的化学键类型是
(4)用电子式表示④⑦元素物质的形成过程
(5)②、④、⑥离子半径由大到小的顺序为
(6)②⑦组成的物质是新的自来水消毒剂,可以用来除去水中超标的锰离子,生成黑色沉淀,当消耗13.50g②⑦组成的物质时,共转移了1mol电子,则反应的离子方程式为
您最近一年使用:0次
名校
4 . 随原子序数递增,八种短周期元素(用字母 等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
(1)f在周期表中的位置是_______ 。
(2) 、
、 两种元素的原子可构成一种碱性物质,该物质的电子式是
两种元素的原子可构成一种碱性物质,该物质的电子式是_______ 。
(3)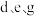 三者简单离子的半径由大到小顺序是(用离子符号表示):
三者简单离子的半径由大到小顺序是(用离子符号表示):_______ 。
(4)写出一个能证明 非金属性强弱的化学方程式:
非金属性强弱的化学方程式:_______ 。
(5)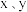 最简单化合物的空间构型为
最简单化合物的空间构型为_______ 。
(6)下列判断不正确的是_______。
 等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。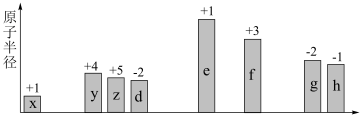
(1)f在周期表中的位置是
(2)
 、
、 两种元素的原子可构成一种碱性物质,该物质的电子式是
两种元素的原子可构成一种碱性物质,该物质的电子式是(3)
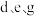 三者简单离子的半径由大到小顺序是(用离子符号表示):
三者简单离子的半径由大到小顺序是(用离子符号表示):(4)写出一个能证明
 非金属性强弱的化学方程式:
非金属性强弱的化学方程式:(5)
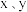 最简单化合物的空间构型为
最简单化合物的空间构型为(6)下列判断不正确的是_______。
A. 和 和 可以形成 可以形成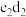 型化合物,正、负离子物质的量之比为 型化合物,正、负离子物质的量之比为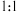 |
B.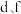 组成的化合物具有两性 组成的化合物具有两性 |
C. 的最高价氧化物对应水化物与 的最高价氧化物对应水化物与 的氢化物反应生成产物中既含有离子键又含有共价键 的氢化物反应生成产物中既含有离子键又含有共价键 |
D. 与 与 同主族,相差两个周期 同主族,相差两个周期 |
您最近一年使用:0次
名校
5 . X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,X与R的最外层电子数相等;Z的内层电子数是最外层电子数的一半,U的最高化合价和最低化合价的代数和为6;R和Q可形成原子数之比为 和
和 的两种化合物:R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应。
的两种化合物:R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应。
请回答下列问题:
(1)Z元素在元素周期表中的位置是_____ ;由上述元素中的四种元素形成的既含有离子键又含有共价键的化合物为_____ (写出其中一种物质的名称)。
(2)Q、R、T三种元素的简单离子半径由小到大顺序为_____ (用离子符号表示)。
(3)T与R二者的最高价氧化物对应的水化物反应的化学方程式为_____ 。T与U二者的最高价氧化物对应的水化物反应的离子方程式为_____ 。
(4)下列可以判断R和T金属性强弱的是_____(填序号)。
(5)Q、R两元素可形成离子化合物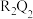 ,
,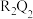 的电子式为
的电子式为_____ ;用电子式表示化合物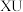 的形成过程
的形成过程_____ 。
 和
和 的两种化合物:R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应。
的两种化合物:R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应。请回答下列问题:
(1)Z元素在元素周期表中的位置是
(2)Q、R、T三种元素的简单离子半径由小到大顺序为
(3)T与R二者的最高价氧化物对应的水化物反应的化学方程式为
(4)下列可以判断R和T金属性强弱的是_____(填序号)。
| A.单质的熔点R比T低 |
| B.单质与酸反应时,失电子数R比T少 |
| C.单质与水反应R比T剧烈 |
| D.最高价氧化物的水化物的碱性R比T强 |
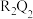 ,
, 的电子式为
的电子式为 的形成过程
的形成过程
您最近一年使用:0次
解题方法
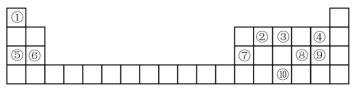
6 . 下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:___________ ,⑦原子结构示意图为___________ 。
(2)⑤、⑥、⑦的简单离子半径由大到小的顺序为___________ (用原子符号和“>”表示)。
(3)④⑧⑨的气态氢化物中,最稳定的是___________ (用化学式表示),最高价氧化物对应水化物中,酸性最强的是___________ (用化学式表示)。
(4)由①③⑨组成的盐化学式为___________ ,其中含有的化学键类型是___________
(2)⑤、⑥、⑦的简单离子半径由大到小的顺序为
(3)④⑧⑨的气态氢化物中,最稳定的是
(4)由①③⑨组成的盐化学式为
您最近一年使用:0次
名校
7 . 元素周期表反映元素之间的内在联系,是研究物质性质的重要工具。如图是元素周期表的一部分,请回答下列问题:
(1)元素③、④、⑧的简单离子半径由大到小 的排序为______ (填离子符号)。
(2)⑤和⑧组成的化合物的电子式为______ 。
化合物X由③和④元素单质高温下反应生成,其含有的化学键为______ (填化学键类型)
(3)⑥的氧化物和②的最高价氧化物对应的水化物反应的离子方程式为______ 。
(4)用一个化学方程式说明非金属性⑧>⑦(不可使用 )
)______ 。
周期 | IA | 0 | |||||||
1 | IIA | … | IIIA | IVA | VA | VIA | VIIA | ||
2 | ① | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)⑤和⑧组成的化合物的电子式为
化合物X由③和④元素单质高温下反应生成,其含有的化学键为
(3)⑥的氧化物和②的最高价氧化物对应的水化物反应的离子方程式为
(4)用一个化学方程式说明非金属性⑧>⑦(不可使用
 )
)
您最近一年使用:0次
名校
解题方法
8 . 元素周期表与元素周期律在化学学习研究中有很重要的作用。下表是元素周期表的一部分
(1)④和②组成的一种化合物颜色为淡黄色,请写出该化合物的电子式_______ ,该化合物含有的化学键类型有_______ 。
(2)请写出元素①的简单氢化物的结构式_______ 。
(3)元素①、②、⑦简单氢化物的稳定性最强的是_______ (用化学式表示) 。
(4)元素①、②、⑧简单氢化物的沸点最高的是_______ (用化学式表示) 。
(5)元素③、⑤、⑨的简单离子半径由大到小的顺序(用离子符号表示)_______ 。
(6)写出元素①最高价氧化物对应水化物稀溶液与铜应的化学方程式_______ 。
(7)元素非金属性强弱比较有很多方法,其中比较⑧和⑨的非金属性强弱的研究方案中不可行的是:_______(填序号)。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | |||||||
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)请写出元素①的简单氢化物的结构式
(3)元素①、②、⑦简单氢化物的稳定性最强的是
(4)元素①、②、⑧简单氢化物的沸点最高的是
(5)元素③、⑤、⑨的简单离子半径由大到小的顺序(用离子符号表示)
(6)写出元素①最高价氧化物对应水化物稀溶液与铜应的化学方程式
(7)元素非金属性强弱比较有很多方法,其中比较⑧和⑨的非金属性强弱的研究方案中不可行的是:_______(填序号)。
| A.比较两种单质的颜色 | B.比较两种单质与 化合的难易程度 化合的难易程度 |
| C.依据两元素在周期表中的位置 | D.比较氧化物对应水化物的酸性 |
您最近一年使用:0次
名校
解题方法
9 . 下表列出9种元素在元素周期表(元素周期表只给出部分)中的位置
请回答下列问题:
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的元素符号是_____ 。
(2)写出由元素②和元素④形成原子个数比为1∶2的化合物的电子式_____ 。某短周期元素的最高正化合价与最低负化合价的代数和为4,该元素在周期表的位置为_____ 。
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物反应的离子方程式为_____ 。
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是_____ (填化学式;用“>”连接)。元素④、⑤、⑧所形成的简单离子半径由大到小的顺序是_____ (用化学符号表示)。
(5)由①、③、⑧三种元素以原子个数比4∶1∶1形成的化合物中含有的化学键类型是_____ (选填“离子键”“极性键”“非极性键”)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | |||||
| 4 | ⑨ |
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的元素符号是
(2)写出由元素②和元素④形成原子个数比为1∶2的化合物的电子式
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物反应的离子方程式为
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是
(5)由①、③、⑧三种元素以原子个数比4∶1∶1形成的化合物中含有的化学键类型是
您最近一年使用:0次
名校
10 . A、B、C、D、E、F是原子序数依次增大的6种短周期主族元素。A元素是动植物生长不可缺少的元素,其单质在空气中含量最高;B元素的最外层电子数是其电子层数的3倍;短周期主族元素中C原子半径最大;C、D、E的最高价氧化物对应水化物两两之间都能反应,元素E最高正化合价与最低负化合价的代数和为4。回答下列问题:
(1)A元素组成单质的电子式_____________ 。E和F的最高价氧化物对应水化物酸性更强的是_____________ (填化学式)。
(2)B、C、D、E四种元素简单离子的离子半径由大到小 的顺序是(填具体的离子符号):______________________ ;
(3)C和B能形成C2B和C2B2两种化合物,用电子式请写出C2B2的形成过程:
_________________________________ 。
(4)已知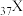 和
和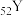 都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
(5)下列物质的变化中未发生化学键破坏的是_____________ (填序号,下同),仅发生离子键破坏的是_____________ ,仅发生共价键破坏的是_____________ ,既发生离子键破坏,又发生共价键破坏的是________________________ .
①氯化钠溶于水、②氯化氢溶于水、③乙醇溶于水、④过氧化钠与水反应、⑤碘升华.
(6)A、B组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐和水。请写出该反应的离子方程式_____________ 。
(1)A元素组成单质的电子式
(2)B、C、D、E四种元素简单离子的离子半径
(3)C和B能形成C2B和C2B2两种化合物,用电子式请写出C2B2的形成过程:
(4)已知
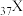 和
和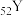 都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);| A.原子半径:X>Y | B.最高价氧化物对应水化物的碱性强弱:X>C |
| C.气态氢化物稳定性强弱:E>Y | D.B与C形成的化合物中不可能含有共价键 |
①氯化钠溶于水、②氯化氢溶于水、③乙醇溶于水、④过氧化钠与水反应、⑤碘升华.
(6)A、B组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐和水。请写出该反应的离子方程式
您最近一年使用:0次



