22-23高三下·湖南·阶段练习
名校
解题方法
1 . LiDFOB是一种新型的电解质锂盐,具有较高的电化学稳定性和电导率,被广泛用于目前的锂电池中。LiDFOB的结构如图所示,其中M、X、Y、Z为位于同一短周期元素,X原子核外的s轨道与p轨道上的电子数之比为2:1,下列叙述正确的是
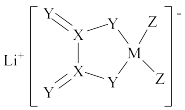
A.X、Y、Z简单气态氢化物的沸点: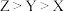 |
| B.X、Y两元素组成的分子一定为非极性分子 |
| C.该化合物中有极性键、非极性键、配位键和离子键 |
| D.该化合物中所有原子的最外层均满足8电子稳定结构 |
您最近一年使用:0次
2023-03-17更新
|
951次组卷
|
4卷引用:化学(全国卷新教材01)-2024年高考押题预测卷
(已下线)化学(全国卷新教材01)-2024年高考押题预测卷湖南省新高考教学教研联盟2023届高三下学期第一次联考化学试题黑龙江省双鸭山市第一中学2022-2023学年高二下学期4月月考(普通班)化学试题黑龙江省双鸭山市第一中学2022-2023学年高二下学期4月月考(实验班)化学试题
名校
解题方法
2 . W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y在元素周期表中的相对位置如图所示,W元素最外层与次外层的电子数之差为3,W的核电荷数与Z元素的最外层电子数之和等于X的原子序数。下列推断正确的是


| A.简单离子半径:Y<Z |
| B.氢化物的稳定性:X<Y<Z |
| C.氧化物对应水化物的酸性:W<X<Z |
| D.化合物WZ3、Y2Z2中既含离子键又含共价键 |
您最近一年使用:0次
2022-03-21更新
|
496次组卷
|
6卷引用:山西省2021-2022学年高三下学期高考考前适应性测试(一模)理综化学试题
山西省2021-2022学年高三下学期高考考前适应性测试(一模)理综化学试题(已下线)专题06物质结构元素周期律-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题06物质结构元素周期律-2022年高考真题+模拟题汇编(全国卷)(已下线)专题06物质结构元素周期律-三年(2020~2022)高考真题汇编(全国卷)(已下线)第一部分 二轮专题突破 专题9 “位—构—性”综合推断福建省福州高级中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
3 . X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素。Y在同周期中原子半径最大,W与X同主族,能形成WX3化合物。已知Z是金属,其氧化物和氢氧化物均显两性。
(1)元素Z在元素周期表中的位置为__ ,Y、Z、W、Q的离子半径从大到小顺序为__ (用离子符号表示)。
(2)Y2X2的电子式为__ ,其化学键类型为__ 。
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为__ ;其最高价氧化物对应的水化物的化学式为__ ,其酸性比硫酸___ (填“强”或“弱”)。
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式__ 。
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式__ 。
(1)元素Z在元素周期表中的位置为
(2)Y2X2的电子式为
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式
您最近一年使用:0次
2022-01-05更新
|
80次组卷
|
2卷引用:山西省运城市新绛中学校2022届高三10月月考化学试题
名校
解题方法
4 . 海洋生物参与氮循环过程如图所示:

下列说法不正确 的是

下列说法
| A.反应①~⑤中包含3个氧化还原反应 |
| B.反应②中有极性键断裂和非极性键生成 |
| C.反应③中可能有氧气参与反应 |
D.等量 参加反应,反应④转移电子数目比反应⑤多 参加反应,反应④转移电子数目比反应⑤多 |
您最近一年使用:0次
2020-12-15更新
|
423次组卷
|
6卷引用:山西省榆社中学2021届高三上学期第六次模块诊断化学试题
5 . 国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
(1)下列氮原子的电子排布图表示的状态中,能量最高的是___________ (填字母标号)。
(2)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如下图所示。已知:元素的一个气态基态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是___________ (填字母标号)。
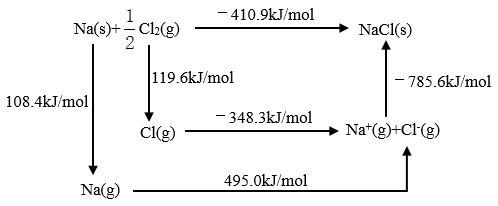
a.Cl-Cl键的键能为119.6kJ/mol
b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol
d.Cl的第一电子亲和能为348.3kJ/mol
(3)乙二胺(H2N—CH2—CH2—NH2)是一种重要的配体,可简写为En。
①乙二胺分子中氮原子的杂化轨道类型为___________ 。
②乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
③乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是___________ (填“Mg2+”或“Cu2+”)。
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有___________ (填字母)。
a.离子键 b.极性键 c.非极性键
d.π键 e.配位键 f.氢键
②1mol[Fe(CN)6]3-中含有的σ键数目为___________ (用NA表示阿伏加德罗常数的值)。
(5)CuF的晶胞结构如下图所示。在CuF晶体中距离Cu+最近的F-有___________ 个。已知CuF的密度为7.5g∙cm-3,则CuF的晶胞参数a=___________ nm(列出计算式)。

(1)下列氮原子的电子排布图表示的状态中,能量最高的是

(2)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如下图所示。已知:元素的一个气态基态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是

a.Cl-Cl键的键能为119.6kJ/mol
b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol
d.Cl的第一电子亲和能为348.3kJ/mol
(3)乙二胺(H2N—CH2—CH2—NH2)是一种重要的配体,可简写为En。
①乙二胺分子中氮原子的杂化轨道类型为
②乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是
③乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有
a.离子键 b.极性键 c.非极性键
d.π键 e.配位键 f.氢键
②1mol[Fe(CN)6]3-中含有的σ键数目为
(5)CuF的晶胞结构如下图所示。在CuF晶体中距离Cu+最近的F-有

您最近一年使用:0次
10-11高一下·安徽滁州·期中
名校
解题方法
6 . 下列关于化学键的说法,正确的是
| A.构成单质分子的粒子一定含有共价键 |
| B.由非金属元素组成的化合物不一定是共价化合物 |
| C.非极性键只存在于双原子单质分子里 |
| D.不同元素组成的多原子分子里的化学键一定是极性键 |
您最近一年使用:0次
2020-02-12更新
|
770次组卷
|
37卷引用:2013届山西省太原五中高三8月月考化学试卷
(已下线)2013届山西省太原五中高三8月月考化学试卷(已下线)2012-2013学年山西省忻州一中高二下学期期中考试化学试卷四川省南充市阆中中学2020届高三化学《极性分子、非极性分子》专题练习山西省运城市新绛县第二中学2019-2020学年高一下学期3月月考化学试题(已下线)2010—2011学年安徽省滁州中学高一下学期期中考试化学试卷(已下线)2010-2011学年江西省上饶市第五中学高一下学期期中考试化学试卷(已下线)2011-2012学年黑龙江海林市高级中学高一下学期期中考试化学试卷 (已下线)2012-2013学年福建省福州文博中学高二上学期期末考试化学试卷(已下线)2012-2013学年吉林省长春市十一中高一下学期期初考试化学试卷(已下线)2012-2013学年江苏省南京学大教育专修学校高一4月月考化学试卷(已下线)2012-2013学年贵州省黔西一中高一第二学期期末检测化学试卷(已下线)2012-2013学年四川省成都七中高一下学期期末考试化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2013-2014吉林省临江一中高一下学期期中考试化学试卷2015-2016学年甘肃天水一中高一下第一次月考理化学卷2015-2016学年黑龙江牡丹江一中高一下期中化学试卷2015-2016学年内蒙古平煤高中高一实验班下期中化学卷2015-2016学年青海师大附二中高一下期中化学试卷甘肃省天水市第三中学2016-2017学年高一下学期第一次月考化学试题四川省成都市双流中学2016-2017学年高二5月月考化学试题宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第2章 分子结构与性质综合练习3黑龙江省大庆十中2017-2018学年高一下学期期末考试化学试题河南省中牟县第一高级中学2018-2019学年高一下学期第一次统一考试化学试题(已下线)2019年4月3日《每日一题》 必修2 化学键的相关判断【全国百强校】吉林省梅河口市第五中学2018-2019学年高一下学期3月月考化学试题甘肃省武威第十八中学2018-2019学年高一下学期期中考试化学试题福建省宁德市六校2018-2019学年高二第二学期期中联合考试化学试题云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题云南省昭通市永善县第二中学2019—2020学年高二上学期期末考试化学试题天津市耀华中学2019-2020学年度高一上学期期末考试化学试题(已下线)【全国百强校】四川省棠湖中学2018-2019学年高一下学期期中考试化学试题辽宁省葫芦岛市2020-2021学年高一上学期期末考试化学试题河南省安阳市洹北中学2020-2021学年高一下学期第一次月考化学试题(已下线)第2.3.1讲 共价键的极性-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)第四章 物质结构 元素周期律 第三节 化学键河南省安阳市第一中学2022-2023学年高一上学期12月月考化学试题福建省建瓯市芝华中学2023-2024学年高二下学期第一次阶段考试化学试题
7 . 下列说法正确的是( )
| A.1H、2H、3H是三种核素,它们物理性质相同,化学性质不同 |
B.ZX3+的结构示意图为 ,该离子能促进水的电离 ,该离子能促进水的电离 |
| C.N2、H2O2、CaC2、MgCl2中都含有非极性共价键 |
| D.由于HF分子间存在氢键,因此HF比HCl稳定 |
您最近一年使用:0次
2010·山西太原·高考模拟
8 . 下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题:
(1)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 (写化学式)。
(2)由表中元素可以组成多种漂白剂,试写出其中两种常用漂白剂的化学式: 、 。
(3)①、④、⑤三种元素形成的化合物中化学键的类型: 。
(4)②和④形成的化合物与④和⑤形成的化合物之间发生氧化还原反应,写出该反应的化学方程式: 。
(5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应:

①X溶液与Y溶液反应的离子方程式为 ;
②已知M为硝酸盐,则M溶液中各离子浓度由大到小排列顺序为:
c( )>c( )>c( )>c( )(在括号内填离子符号)。
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)由表中元素可以组成多种漂白剂,试写出其中两种常用漂白剂的化学式: 、 。
(3)①、④、⑤三种元素形成的化合物中化学键的类型: 。
(4)②和④形成的化合物与④和⑤形成的化合物之间发生氧化还原反应,写出该反应的化学方程式: 。
(5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应:

①X溶液与Y溶液反应的离子方程式为 ;
②已知M为硝酸盐,则M溶液中各离子浓度由大到小排列顺序为:
c( )>c( )>c( )>c( )(在括号内填离子符号)。
您最近一年使用:0次
2012·江苏徐州·三模
名校
解题方法
9 . X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述不正确的是
| A.X与Y能形成两种常见的气态化合物 |
| B.原子半径的大小顺序:r(Z)>r(R)> r(X) > r(Y) |
| C.X、Z分别与R形成的化合物中化学键类型不同 |
| D.含有Y、Z、R三种元素的化合物最多只有2种 |
您最近一年使用:0次
2016-06-24更新
|
127次组卷
|
7卷引用:2015届山西大学附中高三上学期期中化学试卷
(已下线)2015届山西大学附中高三上学期期中化学试卷(已下线)2013届江苏省徐州市高三模底考试化学试卷2015届福建省泉州五校高三上学期摸底联考化学试卷2015-2016学年湖南省浏阳一中高一下第一次阶段测化学卷2015-2016学年辽宁省沈阳二中高一下期中化学试卷福建省厦门双十中学2018-2019学年高二上学期第一次返校考试化学试题浙江省金华市磐安县第二中学2019-2020学年高一下学期期中考试化学试题



