2010·上海浦东新·一模
解题方法
1 . 现有部分短周期元素的性质或结构如下表:
(1)X原子中电子运动状态共有____ 种。Z元素最简单的气态氢化物分子的空间构型是___ 。
(2)写出Y元素最高价氧化物对应水化物的电离方程式____________ 。
(3)下列说法能证明M、Z、X三种元素形成的化合物属于离子化合物的是______ 。
a.熔点比氯化钠高 b.水溶液能导电 c.液态时能导电 d.固体能导电
(4)与X同周期且非金属性强于X的元素是______ (填元素名称),写出能说明这一事实的化学方程式___________ 。
| 元素编号 | 元素性质或结构 |
| X | 海水中质量分数最大的元素,其氢化物是最常用的溶剂 |
| Y | 地壳中含量最多的金属元素 |
| Z | 形成化合物最多的元素 |
| M | 短周期主族元素中原子半径最大的元素 |
(2)写出Y元素最高价氧化物对应水化物的电离方程式
(3)下列说法能证明M、Z、X三种元素形成的化合物属于离子化合物的是
a.熔点比氯化钠高 b.水溶液能导电 c.液态时能导电 d.固体能导电
(4)与X同周期且非金属性强于X的元素是
您最近一年使用:0次
名校
解题方法
2 . 铁、铜及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种;
 易被氧化为
易被氧化为 ,画出
,画出 的结构示意图
的结构示意图___________ 。
(2) 是检验
是检验 的特征试剂,
的特征试剂, 中心离子配位数是
中心离子配位数是___________ ;1mol 中含有
中含有___________ mol 键,能够证明
键,能够证明 不能电离的试剂是
不能电离的试剂是___________ (填化学式)。
(3) 可形成配合物
可形成配合物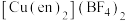 ,其中
,其中 代表
代表 分子。该配合物
分子。该配合物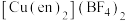 中配位离子所带电荷数为
中配位离子所带电荷数为___________ ,VSEPR模型为四面体的非金属原子共有___________ 个。 单晶的晶胞,其中原子坐标参数A为
单晶的晶胞,其中原子坐标参数A为 ;B为
;B为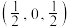 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为___________ 。
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有 易被氧化为
易被氧化为 ,画出
,画出 的结构示意图
的结构示意图(2)
 是检验
是检验 的特征试剂,
的特征试剂, 中心离子配位数是
中心离子配位数是 中含有
中含有 键,能够证明
键,能够证明 不能电离的试剂是
不能电离的试剂是(3)
 可形成配合物
可形成配合物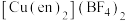 ,其中
,其中 代表
代表 分子。该配合物
分子。该配合物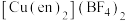 中配位离子所带电荷数为
中配位离子所带电荷数为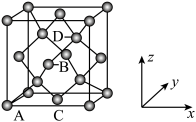
 单晶的晶胞,其中原子坐标参数A为
单晶的晶胞,其中原子坐标参数A为 ;B为
;B为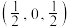 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为
您最近一年使用:0次
名校
3 .  是元素周期表前四周期中的四种常见元素,其相关信息如下表:
是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)元素X的原子中能量最高的是_______ 电子,其电子云在空间有_______ 方向;它的氢化物的电子式是_______
(2)元素Y位于元素周期表的第三周期_______ 族。该原子的价电子排布图为_______ 。
(3)元素Z的原子最外层共有_______ 种不同运动状态的电子。
(4)元素Y与元素Z相比,非金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ 。
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
 是元素周期表前四周期中的四种常见元素,其相关信息如下表:
是元素周期表前四周期中的四种常见元素,其相关信息如下表: | 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且最高能级是半充满状态 |
| Y | 第三周期元素,它的单质是良好的半导体材料 |
| Z | Z和Y同周期,Z是本周期原子半径最小的主族元素 |
| W | W的一种核素的质量数为63,中子数为34 |
(2)元素Y位于元素周期表的第三周期
(3)元素Z的原子最外层共有
(4)元素Y与元素Z相比,非金属性较强的是
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
您最近一年使用:0次
4 . 镁元素在自然界分布广泛,是人体的必需元素之一。工业上可用硅热法(Pidgeon法)冶炼镁,以煅白(CaO·MgO,M = 96 g/mol)为原料与硅铁(含硅75%)混合置于密闭还原炉,1200℃下发生反应:2(CaO·MgO)(s) + Si(s)⇌Ca2SiO4 (l)+2Mg(g);完成下列填空:
(1)已知还原性Mg > Si,上述反应仍能发生的原因是_______ 。
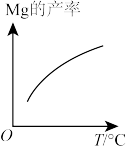
(2)由图推测上述反应正向为_______ (填“吸热”或“放热”)反应。
(3)若还原炉体积不变,能证明上述反应达到平衡的是_______ (选填序号)。
a.平衡常数到达最大值
b.反应物不再转化为生成物
c.炉内Ca2SiO4与CaO·MgO的质量比保持不变
d.单位时间内,n(CaO·MgO)消耗 :n(Ca2SiO4)生成 = 2:1
(4)平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将_______ (填“升高”“降低”或“不变”)。
(5)若还原炉容积为400 m3,原料中煅白质量为9600 kg,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率_______ mol/(L·h)。
(6)工业上也可用电解法来制备镁。相关化合物的熔点如表所示:
①镁原子核外有_______ 种能量不同的电子,它们的运动状态有_______ 种。
②MgCl2的电子式为_______ ;
③判断工业上应选择MgCl2还是MgO作为电解原料并说明理由_______
(1)已知还原性Mg > Si,上述反应仍能发生的原因是
(2)由图推测上述反应正向为

(3)若还原炉体积不变,能证明上述反应达到平衡的是
a.平衡常数到达最大值
b.反应物不再转化为生成物
c.炉内Ca2SiO4与CaO·MgO的质量比保持不变
d.单位时间内,n(CaO·MgO)消耗 :n(Ca2SiO4)生成 = 2:1
(4)平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将
(5)若还原炉容积为400 m3,原料中煅白质量为9600 kg,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率
(6)工业上也可用电解法来制备镁。相关化合物的熔点如表所示:
| MgCl2 | MgO | |
| 熔点/℃ | 712 | 2850 |
①镁原子核外有
②MgCl2的电子式为
③判断工业上应选择MgCl2还是MgO作为电解原料并说明理由
您最近一年使用:0次
名校
解题方法
5 . 碳和硅在元素周期表中都处于第ⅣA族,但他们的性质并不相同,碳和硅的性质差异清晰地显示出它们各自在有机化学和无机化学(硅酸盐)中占据统治地位的作用。
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___ 形象化描述,基态硅原子的核外电子排布式为___ ,其基态原子核外有___ 种不同空间运动状态的电子。
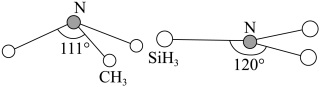
(2)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物结构和性质存在较大差异。化合物N(CH3)3(三角锥形)和N(SiH3)3(平面形)的结构如图所示,则二者中N的杂化方式分别为___ 。更易形成配合物的是___ 。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同。
第IIA族部分碳酸盐受热分解温度
试解释,ⅡA族碳酸盐的分解温度随着阳离子半径的增大逐步升高的原因___ 。
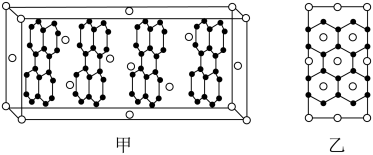
(4)石墨烯与金属R可以形成一种插层化合物。其中R层平行于石墨层,晶胞如图甲所示,其垂直于石墨层方向的投影如图乙所示。则该插层化合物的化学式为___ 。
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(2)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物结构和性质存在较大差异。化合物N(CH3)3(三角锥形)和N(SiH3)3(平面形)的结构如图所示,则二者中N的杂化方式分别为

(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同。
第IIA族部分碳酸盐受热分解温度
| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
(4)石墨烯与金属R可以形成一种插层化合物。其中R层平行于石墨层,晶胞如图甲所示,其垂直于石墨层方向的投影如图乙所示。则该插层化合物的化学式为

您最近一年使用:0次
6 . 确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______ ; B.______ ; C._____ ; D._____ 。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:

则该4种离子晶体的熔点从高到低的顺序是______ 。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____ ,X+的价电子排布式为_____ ,与同一个N3-相连的X+有_____ 个,这几个X+所形成的空间构型为_____ 。

(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:

| 离子晶体 | KCl | MgO | CaO |
| 晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是

您最近一年使用:0次
11-12高二上·四川成都·期中
7 . 四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
(1)B元素在周期表中的位置是____ 区 ,写出A离子的电子排布式_______________
(2)写出C单质与水反应的离子方程式___________________________________
(3)A、B、C、 D四种元素的第一电离能由大到小的顺序______________________
(4)A、B两元素非金属性较强的是(写元素符号)________ 。写出证明这一结论的一个实验事实 _________________________________________________________________
| 元素 | A | B | C | D |
| 性质 结构 信息 | 室温下单质呈粉末状固体,加热易熔化。单质在纯氧中燃烧,发出明亮的蓝紫色火焰。 | 单质常温、常压下是气体,能溶于水。原子的M层有1个未成对的p电子。 | 单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 | 原子最外电子层上s电子数等于p电子数,等于电子层数。 |
(1)B元素在周期表中的位置是
(2)写出C单质与水反应的离子方程式
(3)A、B、C、 D四种元素的第一电离能由大到小的顺序
(4)A、B两元素非金属性较强的是(写元素符号)
您最近一年使用:0次
8 . 下列说法不正确的是
| A.p能级能量一定比s能级的能量高 |
| B.d区、ds区全部是金属元素 |
| C.2p和3p轨道形状均为哑铃形 |
D.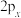 、 、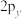 、 、 轨道相互垂直,但能量相等 轨道相互垂直,但能量相等 |
您最近一年使用:0次
解题方法
9 . CO2可被催化还原为HCOOH、CH3OH和CO等,下列说法错误的是
| A.CH3OH中C—O—H键角为109°28' |
| B.CO分子内存在轴对称的电子云 |
| C.CO2中的C原子采取sp杂化 |
| D.HCOOH分子间可形成氢键 |
您最近一年使用:0次
名校
10 . 氨基酸可与某些金属形成盐,用来沉淀和鉴别氨基酸。甘氨酸的铜盐结构如下。下列说法错误的是
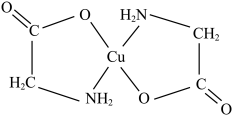
A. 的配位数为4 的配位数为4 | B.H原子与N原子形成的是s-pσ键 |
C.基态Cu原子最外层电子排布式是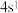 | D.基态N原子核外电子的空间运动状态有5种 |
您最近一年使用:0次



