名校
解题方法
1 . 根据元素周期律回答下列问题:
(1)B(硼元素)在元素周期表中与 同主族,已知:
同主族,已知: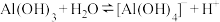 ,则
,则 的电离方程式为
的电离方程式为___________________________________ 。酸性:
__________  (填“>”或“<”)
(填“>”或“<”)
(2) 和镁粉混合点燃可得单质B,该反应的化学方程式为
和镁粉混合点燃可得单质B,该反应的化学方程式为_________________ 。
(3) 可用于生产储氢材料
可用于生产储氢材料 。
。 具有强还原性。在碱性条件下,
具有强还原性。在碱性条件下, 与
与 溶液反应可得
溶液反应可得 和
和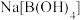 ,其中H元素由
,其中H元素由 价升高为
价升高为 价。
价。
①写出基态 核外电子排布式
核外电子排布式______________ ; 基态核外电子排布图
基态核外电子排布图_________________
②基态B原子中能量最高的是__________ 电子,其电子云在空间呈现____________ 形
③写出碱性条件下, 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:__________________
(1)B(硼元素)在元素周期表中与
 同主族,已知:
同主族,已知: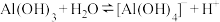 ,则
,则 的电离方程式为
的电离方程式为
 (填“>”或“<”)
(填“>”或“<”)(2)
 和镁粉混合点燃可得单质B,该反应的化学方程式为
和镁粉混合点燃可得单质B,该反应的化学方程式为(3)
 可用于生产储氢材料
可用于生产储氢材料 。
。 具有强还原性。在碱性条件下,
具有强还原性。在碱性条件下, 与
与 溶液反应可得
溶液反应可得 和
和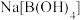 ,其中H元素由
,其中H元素由 价升高为
价升高为 价。
价。①写出基态
 核外电子排布式
核外电子排布式 基态核外电子排布图
基态核外电子排布图②基态B原子中能量最高的是
③写出碱性条件下,
 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:
您最近一年使用:0次
2 . 工业上用Fe(Ⅲ)作为可再生氧化剂回收工业废气中的H2S,生产单质硫。
(1)铁元素属于_______ 区(填“s”、“d”、“ds”、“p”)。
(2)Fe3+生化氧化再生法分为吸收和再生两部分。
①吸收:用Fe3+将H2S氧化为S,该反应的离子方程式是_______ 。
②再生:O2在氧化亚铁硫杆菌作用下再生Fe3+。
缺点:氧化亚铁硫杆菌生长的最佳pH范围是1.4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因_______ 。
(3)络合铁法脱硫技术吻合节能减排、经济高效的工业化指导思想。
①碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,请在图中用“↑”或“↓”补全Fe3+的电子分布图。从图中可以看出Fe3+有空轨道,可以形成溶于水的Fe3+Ln(配合物,L表示配体,n表示配位数)。_______
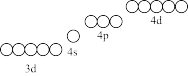
②ⅰ.写出碱性条件下Fe3+Ln氧化H2S生成S8的离子方程式_______ 。
ⅱ.O2氧化再生Fe3+Ln的离子方程式:4Fe2+Ln+O2+2H2O=4Fe3+Ln+4OH−
写出总反应的化学方程式_______ 。
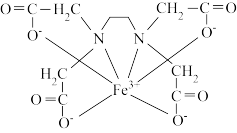
③下图是EDTA与Fe3+形成配合物的结构示意图,Fe3+外层空轨道采取sp3d2杂化,1mol该配合物中配位键有_______ mol。
(1)铁元素属于
(2)Fe3+生化氧化再生法分为吸收和再生两部分。
①吸收:用Fe3+将H2S氧化为S,该反应的离子方程式是
②再生:O2在氧化亚铁硫杆菌作用下再生Fe3+。
缺点:氧化亚铁硫杆菌生长的最佳pH范围是1.4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因
(3)络合铁法脱硫技术吻合节能减排、经济高效的工业化指导思想。
①碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,请在图中用“↑”或“↓”补全Fe3+的电子分布图。从图中可以看出Fe3+有空轨道,可以形成溶于水的Fe3+Ln(配合物,L表示配体,n表示配位数)。
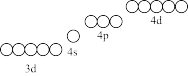
②ⅰ.写出碱性条件下Fe3+Ln氧化H2S生成S8的离子方程式
ⅱ.O2氧化再生Fe3+Ln的离子方程式:4Fe2+Ln+O2+2H2O=4Fe3+Ln+4OH−
写出总反应的化学方程式
③下图是EDTA与Fe3+形成配合物的结构示意图,Fe3+外层空轨道采取sp3d2杂化,1mol该配合物中配位键有

您最近一年使用:0次
2022-04-02更新
|
389次组卷
|
2卷引用:北京市石景山区2022届高三一模化学试题
名校
解题方法
3 . 我国科学家研发的新型光学材料(Sn7Br10S2)可替代传统光学材料硫镓银(AgGaS2)和磷锗锌(ZnGeP2)。请回答下列问题:
(1)基态硫原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为___________ 。
(2)SF6可用作高压发电系统的绝缘气体,其分子呈正八面体结构,如图所示。
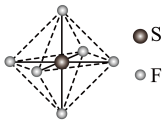
①SF6是___________ (填“极性”或“非极性”)分子。
②1molSF6分子中含___________ molσ键。
(3)HF、HCl、HBr的酸性由强到弱的顺序为___________ (填化学式,下同);沸点由高到低的顺序为___________ ;还原性由强到弱的顺序为___________ 。
(4)Ga(CH3)3和NH3在一定条件下可合成半导体材料GaN和CH4。Ga(CH3)3分子中Ga原子和C原子构成的空间构型是___________ ,碳原子的杂化类型是___________ 。
(5)四卤化锡的熔点如下表所示:
它们熔点递变的主要原因是___________ 。
(1)基态硫原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为
(2)SF6可用作高压发电系统的绝缘气体,其分子呈正八面体结构,如图所示。

①SF6是
②1molSF6分子中含
(3)HF、HCl、HBr的酸性由强到弱的顺序为
(4)Ga(CH3)3和NH3在一定条件下可合成半导体材料GaN和CH4。Ga(CH3)3分子中Ga原子和C原子构成的空间构型是
(5)四卤化锡的熔点如下表所示:
| 物质 | SnCl4 | SnBr4 | SnI4 |
| 熔点/℃ | ﹣33 | 31 | 144.5 |
您最近一年使用:0次
名校
解题方法
4 . 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法错误的是

| A.Y单质的氧化性在同主族中最强 |
| B.Z的基态原子中含有11种不同空间运动状态的电子 |
| C.Z与Y可组成多种离子化合物 |
| D.第一电离能:Y>W>X |
您最近一年使用:0次
解题方法
5 . 已知:NHCl2在水中产生几种化合物,其中一种物质M具有强氧化性且常用于自来水的消毒。下列有关说法错误的是
| A.基态N原子核外有3种不同能量的电子 |
| B.化合物M是次氯酸 |
| C.M分子的空间构型是直线形 |
| D.NHCl2分子中氮原子的杂化类型为sp3 |
您最近一年使用:0次
6 . 元素周期表被认为是“科学共同的语言”,它的发现使化学学习和研究变得有规律可循。其简洁有序的背后,是众多科学家艰苦奋斗的结果。下图是元素周期表的一部分,请按要求回答下列问题:

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为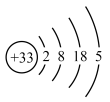 ,砷在周期表中的位置是
,砷在周期表中的位置是___________ 。我国“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。原子半径:Ga___________ As(填“>”或“<”)。
(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途___________ 。
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为___________ (填化学式)。
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是___________ 。
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
(6)小赵同学在研究元素周期表时发现,碳元素有“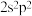 ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是___________ 。

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为
 ,砷在周期表中的位置是
,砷在周期表中的位置是(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
| A.“类钫”在化合物中显+1价 |
| B.“类钫”单质具有强氧化性 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 |
| D.“类钫”单质能与冷水剧烈反应 |
(6)小赵同学在研究元素周期表时发现,碳元素有“
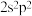 ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是
您最近一年使用:0次
名校
解题方法
7 . 许多物质中同一元素可以存在多种化合价, 或是可以看成存在多种化合价,这样有助于把握某些反应的本质。元素R是最高化合价为+6的短周期元素,Na2R2O8是一种极强的氧化剂,该物质的某种元素可以看成存在多种化合价。注:回答下列问题时,必须用R元素的真实元素符号作答。
(1)R元素的基态原子中,具有_______ 种不同空间运动状态的电子,具有_______ 种不同运动状态的电子。
(2)已知氧化性: >
> >I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到
>I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到_______ 的现象。该过程中被还原的元素是_______ 。
(3)加热Na2R2O8溶液,可以放出一种无色无味气体,结合上述信息,写出该反应的化学方程式_______ 。
(1)R元素的基态原子中,具有
(2)已知氧化性:
 >
> >I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到
>I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到(3)加热Na2R2O8溶液,可以放出一种无色无味气体,结合上述信息,写出该反应的化学方程式
您最近一年使用:0次
8 . 下列推断合理的是
A.O的非金属性比S大,可推断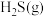 比 比 稳定 稳定 |
B.电子云重叠程度 比 比 的大,可推断 的大,可推断 比 比 稳定 稳定 |
C. 的相对分子质量比 的相对分子质量比 小,可推断 小,可推断 的沸点比 的沸点比 的低 的低 |
D. 具有氧化性,可推断过硫化氢( 具有氧化性,可推断过硫化氢(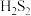 )也具有氧化性 )也具有氧化性 |
您最近一年使用:0次
9 . 我国科学家研发Fe2O3/C3N4催化剂设计锂氧电池。请回答下列问题:
(1)Fe2O3中基态铁离子的价层电子排布图为___________ 。
(2)基态O原子核外电子云轮廓图为哑铃形的原子轨道上占据___________ 个电子。
(3)C3N4晶体的熔点为3550℃,耐磨,它的晶体类型是___________ 。
(4)我国科学家利用足球烯成功制备次晶金刚石,金刚石中C原子杂化类型为___________ 。石墨晶体层与层之间以___________ 结合。
(5)某新型材料碳化铁的晶胞如图所示。

①1个铁原子与___________ 个铁原子最近且等距离。
②该晶胞有___________ 个碳原子。
③每个晶胞中由铁原子形成的正四面体空隙有___________ 个。
(1)Fe2O3中基态铁离子的价层电子排布图为
(2)基态O原子核外电子云轮廓图为哑铃形的原子轨道上占据
(3)C3N4晶体的熔点为3550℃,耐磨,它的晶体类型是
(4)我国科学家利用足球烯成功制备次晶金刚石,金刚石中C原子杂化类型为
(5)某新型材料碳化铁的晶胞如图所示。

①1个铁原子与
②该晶胞有
③每个晶胞中由铁原子形成的正四面体空隙有
您最近一年使用:0次
名校
解题方法
10 . 现有短周期元素A、B、C、D。A元素M层上有2对成对电子,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要肥料。
(1)A的原子最外层共有___ 种不同运动状态的电子,该原子共有___ 种不同能量的电子,能量最高的电子占有___ 个轨道,其电子云形状为____ 。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,该化合物在实验室制备乙酸乙酯时所起的作用:_____ 。
(3)B与C元素形成带一个单位正电荷的离子,写出该微粒的电子式____ 。
(4)元素A与元素D相比,非金属性较强的是____ (用元素符号表示),下列表述中能表明这一事实的是____ 。
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
从原子结构分析A和D非金属强弱的原因_____ 。
(5)C原子的原子结构示意图:_____ ,C的氢化物固态时属于____ 晶体。
(1)A的原子最外层共有
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,该化合物在实验室制备乙酸乙酯时所起的作用:
(3)B与C元素形成带一个单位正电荷的离子,写出该微粒的电子式
(4)元素A与元素D相比,非金属性较强的是
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
从原子结构分析A和D非金属强弱的原因
(5)C原子的原子结构示意图:
您最近一年使用:0次



