名校
1 . 若将14Si的电子排布式写成1s22s22p63s23p ,它违背了
,它违背了
 ,它违背了
,它违背了| A.能量守恒原理 | B.泡利原理 | C.能量最低原理 | D.洪特规则 |
您最近一年使用:0次
2021-05-21更新
|
230次组卷
|
7卷引用:2015-2016学年新疆伊犁州伊宁二中高二下期末化学试卷
2015-2016学年新疆伊犁州伊宁二中高二下期末化学试卷云南省新平县一中2018-2019学年高二上学期12月考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题【全国百强校】吉林省长春市外国语学校2018-2019学年高二下学期期中考试化学试题云南省盈江县第一高级中学2019-2020学年高二上学期期末考试化学试题福建省莆田第七中学2020-2021学年高二下学期期中考试化学(A卷)试题(已下线)第1.1.3讲 泡利原理、洪特规则、能量最低原理 -2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
解题方法
2 . 按要求填空:
(1)元素周期表中,电负性最大的元素是___ (填元素符号),其氢化物为___ 酸(填“强”、“中强”“弱”)。
(2)以下是一些原子的2p能级和3d能级中电子排布的情况。试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
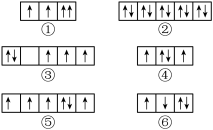
违反泡利不相容原理的有___ (填序号,下同),违反洪特规则的有___ 。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。根据价层电子对互斥理论,预测ClO 的VSEPR模型
的VSEPR模型___ 形,空间构型为___ 形。
(1)元素周期表中,电负性最大的元素是
(2)以下是一些原子的2p能级和3d能级中电子排布的情况。试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。

违反泡利不相容原理的有
(3)海洋是元素的摇篮,海水中含有大量卤族元素。根据价层电子对互斥理论,预测ClO
 的VSEPR模型
的VSEPR模型
您最近一年使用:0次
3 . I以下是一些原子的2p能级和3d能级中电子排布的情况。试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
①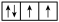 ②
② ③
③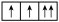 ④
④ ⑤
⑤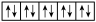
(1)违反泡利不相容原理的有___________
(2)违反洪特规则的有___________ 。
II含氧酸可表示为:(HO)mROn,酸的强度与酸中的非羟基氧原子数n有关,n越大,酸性越强。一般n=0弱酸,n=1中强酸,n=2强酸,n=3超强酸。据实验事实可知:硼酸(H3BO3)是弱酸,亚磷酸是中强酸(H3PO3)。
(3)写出两种酸的结构式:___________ 、___________ 。
(4)写出亚磷酸与过量的NaOH反应的方程式___________ 。
①
 ②
② ③
③ ④
④ ⑤
⑤
(1)违反泡利不相容原理的有
(2)违反洪特规则的有
II含氧酸可表示为:(HO)mROn,酸的强度与酸中的非羟基氧原子数n有关,n越大,酸性越强。一般n=0弱酸,n=1中强酸,n=2强酸,n=3超强酸。据实验事实可知:硼酸(H3BO3)是弱酸,亚磷酸是中强酸(H3PO3)。
(3)写出两种酸的结构式:
(4)写出亚磷酸与过量的NaOH反应的方程式
您最近一年使用:0次
名校
解题方法
4 . 下列说法正确的是
| A.将过量的氨水加入到CuSO4溶液中,最终得到蓝色沉淀 |
| B.电子排布式(22Ti)1s22s22p63s23p10违反了洪特规则 |
| C.由于氢键的作用,H2O的稳定性强于H2S |
| D.双键中一定有一个σ键和一个π键,三键中一定有一个σ键和两个π键 |
您最近一年使用:0次
2020-10-18更新
|
107次组卷
|
2卷引用:四川省威远中学2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
5 . 根据相关物质结构理论,回答下列问题:
(1)以下列出的是一些原子的2p能级和3d能级中电子排布图及Sc的电子排布式。试判断,违反了泡利原理的是___ ,违反了洪特规则的是___ ,违反了能量最低原理的是___ 。
① ②
②  ③
③ ④
④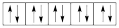 ⑤(21Sc)1s22s22p63s23p63d3
⑤(21Sc)1s22s22p63s23p63d3
(2)某种原子的结构示意图为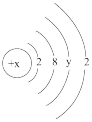 。则该原子的核电荷数x取值范围为
。则该原子的核电荷数x取值范围为___ 。
(3)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+__ Fe3+(填“大于”或“小于”),原因是__ 。
(1)以下列出的是一些原子的2p能级和3d能级中电子排布图及Sc的电子排布式。试判断,违反了泡利原理的是
①
 ②
②  ③
③ ④
④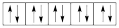 ⑤(21Sc)1s22s22p63s23p63d3
⑤(21Sc)1s22s22p63s23p63d3(2)某种原子的结构示意图为
 。则该原子的核电荷数x取值范围为
。则该原子的核电荷数x取值范围为(3)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+
您最近一年使用:0次
名校
解题方法
6 . 现有七种元素A、B、C、D、E、F、G,其中A、B、C为三个不同周期的短周期元素,E、F、G为第四周期元素。请根据下列相关信息,回答问题。
(1)C基态原子中能量最高的电子,其电子云在空间有__ 个方向,原子轨道呈__ 形,C简单离子核外有__ 种运动状态不同的电子。
(2)A2B2难溶于CS2,简要说明理由:__ 。
(3)G位于__ 族__ 区,它的一种氧化物常用于工业生产硫酸的催化剂,已知G在该氧化物中的化合价等于其价电子数,则该氧化物的化学式为__ ;F晶体的空间堆积方式为__ 。
(4)ED3分子的VSEPR模型名称为__ ,其中E原子的杂化轨道类型为__ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数与s电子数相等 |
| C基态原子的价电子排布为nsn-1npn+1 |
| D的能层数与C相同,且电负性比C大 |
| E元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第五列 |
(1)C基态原子中能量最高的电子,其电子云在空间有
(2)A2B2难溶于CS2,简要说明理由:
(3)G位于
(4)ED3分子的VSEPR模型名称为
您最近一年使用:0次
7 . 下列说法不正确的是( )
| A.Xe元素的所在族的原子的价电子排布式均为ns2np6,属于非金属元素 |
| B.在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外) |
C.某基态原子的核外电子排布图为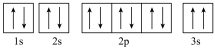 ,它违背了泡利原理 ,它违背了泡利原理 |
| D.某价电子排布为3d14s2的基态原子,该元素位于周期表中第四周期第ⅢB族 |
您最近一年使用:0次
名校
解题方法
8 . 据世界权威刊物《自然》最近报道, 选择碲化锆 (ZrTe5)为材料验证了三维量子霍尔效应, 并发现了金属-绝缘体的转换。Te属于ⅥA元素。回答下列问题:
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是___ ,Zr2+的价电子排布图是___ 。
(2)O、Se、Te的第一电离能由大到小的顺序是___ ,H2O、H2Se、H2Te的沸点由高到低的顺序是___ 。
(3)H2Te和CO2均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是___ 。
(4) [Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是___ (填符号), 1个[Zr(C2H5O)2]2+离子中含共价键的数目是___ 。
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是___ 。若晶胞中距离最近的两个氧原子间的距离为anm,则立方氧化锆的密度为___ g/cm3。
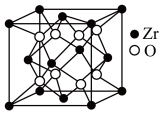
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是
(2)O、Se、Te的第一电离能由大到小的顺序是
(3)H2Te和CO2均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是
(4) [Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是

您最近一年使用:0次
2020-05-24更新
|
622次组卷
|
5卷引用:四川省泸州市2020届高三第三次教学质量诊断性考试理综化学试题
四川省泸州市2020届高三第三次教学质量诊断性考试理综化学试题(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编2020年全国卷Ⅲ化学真题变式题宁夏银川一中2022届高三第一次月考理科综合化学试题宁夏青铜峡市高级中学2021-2022学年高三上学期第一次月考化学试题
名校
解题方法
9 . 某原子核外电子排布为ns2np7,它违背了( )
| A.泡利原理 | B.能量最低原理 | C.洪特规则 | D.洪特规则特例 |
您最近一年使用:0次
2020-05-20更新
|
508次组卷
|
16卷引用:2015-2016学年宁夏六盘山中学高二下第一次月考化学卷
2015-2016学年宁夏六盘山中学高二下第一次月考化学卷2015-2016学年湖北省黄香、航天等校高二下学期期末联化学试卷人教版2017-2018学年高二化学选修三同步训练:1.1 原子结构(第2课时)云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题广西壮族自治区蒙山县第一中学2019-2020学年高二下学期期末考试化学试题广西蒙山一中2018-2019学年高二下学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高二上学期期末考试化学试题江西省都昌县第三中学2019-2020学年高二下学期4月考试化学试题江西省都昌县第一中学2019-2020学年高二下学期期中线上考试化学试题广西贺州市平桂区平桂高级中学2019-2020学年高二下学期第一次月考化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题(人教版2019)选择性必修2第一章 原子结构与性质 第一节 原子结构 第4课时 泡利原理 洪特规则 能量最低原理(已下线)第一章 原子结构与性质【过关测试基础卷】-2020-2021学年高二化学单元复习测试(新教材人教版选择性必修2)山西省太原市第五十六中学校2020-2021学年高二第一次月考化学试题安徽省合肥市第一中学2022-2023学年高二下学期第一次质量检测化学试题
名校
10 . 下列关于物质的组成、结构或性质的叙述中,正确的是
①HF的稳定性很强,是因为其分子间能形成氢键
②基态原子价电子排布式为(n-1)d6~8ns2的元素属于第ⅧB族
③能层为1时,有自旋方向相反的两个轨道
④“量子化”就是连续的意思,微观粒子运动均有此特点
⑤前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有5种
⑥次氯酸分子的电子式:
⑦氯离子与硫离子的核外电子排布相同,都是1s22s22p63s23p6,两粒子的3p能级上的电子离核的距离相同
⑧S2-、Cl-、K+、Na+半径逐渐减小
⑨最外层有3个未成对电子的原子一定属于主族元素
①HF的稳定性很强,是因为其分子间能形成氢键
②基态原子价电子排布式为(n-1)d6~8ns2的元素属于第ⅧB族
③能层为1时,有自旋方向相反的两个轨道
④“量子化”就是连续的意思,微观粒子运动均有此特点
⑤前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有5种
⑥次氯酸分子的电子式:

⑦氯离子与硫离子的核外电子排布相同,都是1s22s22p63s23p6,两粒子的3p能级上的电子离核的距离相同
⑧S2-、Cl-、K+、Na+半径逐渐减小
⑨最外层有3个未成对电子的原子一定属于主族元素
| A.①③④⑦⑧ | B.⑤⑧⑨ | C.②③⑤⑥⑦⑨ | D.②⑦⑧⑨ |
您最近一年使用:0次



