1 . 下列关于价电子排布3s23p4的描述正确的是
| A.它的元素符号为O |
| B.它的核外电子排布式为1s22s22p63s23p4 |
| C.可以与H2化合生成液态化合物 |
D.其电子排布图为 |
您最近一年使用:0次
2024-04-13更新
|
213次组卷
|
44卷引用:2011-2012学年内蒙古包头三十三中高二下学期期中考试化学试卷
(已下线)2011-2012学年内蒙古包头三十三中高二下学期期中考试化学试卷(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2011-2012学年河南许昌鄢陵一高高二下学期期中考试化学试卷(已下线)2012-2013学年山东省淄博市沂源一中高二下学期期中模块检测化学卷(已下线)2012-2013学年山东省济南一中高二下学期期中考试理科化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷2013-2014山东省即墨市高二下学期期中考试化学试卷宁夏育才中学2016-2017学年高二下学期期中考试化学试题江苏省盘湾中学、陈洋中学2017-2018学年高二上学期期中联考(选修)化学试题新疆维吾尔自治区北京大学附属中学新疆分校2018-2019学年高二下学期期中考试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题湖北省仙桃市汉江中学2018-2019学年高二下学期期中考试化学试题宁夏石嘴山市平罗中学2021-2022学年高二上学期期中考试化学试题(已下线)吉林一中2009--2010学年度下学期期末考试第一次质量检测高二化学试卷(已下线)2012届浙江省杭州高中高三第二次月考化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷2016-2017学年高中化学选修3(人教版)模块综合测评【全国校级联考】新疆昌吉市教育共同体四校2017-2018学年高二下学期期末联考化学试题云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高二上学期期末考试化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题福建省长泰县第一中学2018-2019学年高二下学期期末考试化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题江苏省盐城市伍佑中学2019-2020学年高二下学期第一次阶段考试化学试题湖北省武汉市黄陂区第六中学2019-2020学年高二下学期三月线上考试化学试题新疆新源县第二中学2019-2020学年高二下学期期末考试化学试题(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)宁夏青铜峡市高级中学2021-2022学年高二上学期期末考试化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年高二下学期第一次月考化学试题宁夏吴忠市吴忠中学2022-2023学年高三上学期阶段性测试 化学试题河北省保定高碑店市崇德实验中学2022-2023学年高三上学期10月月考化学试题重庆市西南大学附属中学校2022-2023学年高二上学期开学定时训练化学试题(广延班)(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省南昌市八一中学2022-2023学年高二上学期1月期末考试化学试题(已下线)第01讲 原子结构-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)选择题6-10(已下线)第一章章节专项提升贵州省遵义市桐梓县荣兴高级中学2023-2024学年高二下学期第一次(3月)月考化学试题
2 . 下列说法或有关化学用语的表达正确的是
| A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B.基态Fe原子的外围电子排布图为: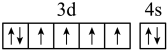 |
| C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
您最近一年使用:0次
2024-02-04更新
|
203次组卷
|
62卷引用:内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题
内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2015-2016学年贵州省思南中学高二下期中化学试卷2015-2016学年辽宁省五校协作体高二下学期期中考试化学试卷陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期期中考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题福建省莆田市仙游县第二中学2019-2020学年高二下学期期中考试化学试题四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题天津市实验中学滨海学校2020-2021学年高二下学期期中化学试题甘肃省武威第十八中学2020-2021学年高二下学期期中考试化学试题四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题福建省泉州科技中学2021-2022学年高二下学期期中考试化学试题宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题四川省广元中学2022-2023学年高二下学期5月期中考试化学试题安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷山西省大同市第一中学2016-2017学年高二5月月考化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题贵州省思南中学2016-2017学年高二下学期期末考试化学试题2017-2018学年人教版高中化学选修三 模块综合质量检测吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题四川省广安市第二中学校2017-2018学年高二下学期第二次月考化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题吉林省扶余市第一中学2018-2019学年高二下学期第一次月考化学试题山东省聊城市2019-2020学年高三化学一轮复习《物质结构与性质(》模拟测试四川省广安第二中学校2017-2018学年高二下学期第一次月考化学试题辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题广西靖西市第二中学2019-2020学年高二下学期开学考试化学试题江苏省如东高级中学2019-2020学年高一下学期第二次阶段测试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记山东省济南市济阳区闻韶中学2020-2021学年高三(3班)12月第一次模拟考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题辽宁省本溪市第二高级中学2021-2022学年高二上学期期末考试化学试题山西省长治市沁源县第一中学等名校2021-2022学年高二下学期5月联考化学试题吉林地区普通高中友好学校联合体2021-2022学年高二下学期期末考试化学试题第一章 本章复习提升1云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题甘肃省庆阳市第六中学2021-2022学年高二下学期期末考试化学试题新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题重庆市荣昌永荣中学校2021-2022学年高二下学期期末考试化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次大单元考试化学试题山东省青岛第十九中学2022-2023学年高二下学期4月月考化学试题河北省唐山市开滦一中2022-2023学年高二下学期期末考试化学试题吉林省普通高中友好学校联合体2023-2024学年高二上学期第三十七届基础年段期末联考化学试题湖南省长郡中学2023-2024学年高二下学期寒假检测(开学考试)化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题(已下线)猜想01 原子结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
3 . 按要求回答下列问题。
(1)基态氮原子价层电子排布图为_______ ,电子占据最高能级的电子云轮廓图形状为_______ 。
(2)基态Ni原子的电子排布式为_______ ,该元素位于元素周期表的第_______ 族。
(3)基态Fe原子有_______ 个未成对电子,Fe位于周期表的_______ 区, 的价层电子排布式为
的价层电子排布式为_______ 。
(4)C、N、O三种元素第一电离能从小到大的顺序为_______ 。
(5)基态Ti原子核外电子排布的能量最高的能级符号是_______ 。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_______ 种。
(6)磷和砷是同一主族的元素,第一电离能:磷_______ 砷(填“>”“<”或“=”,下同),它们形成的氢化物的沸点:
_______  ,原因是
,原因是_______ 。
(7)已知第三电离能数据: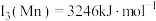 ,
,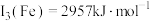 锰的第三电离能大于铁的第三电离能,其主要原因是
锰的第三电离能大于铁的第三电离能,其主要原因是_______ 。
(8)据报道,在 的催化下,甲醛可被氧化成
的催化下,甲醛可被氧化成 ,在处理含HCHO的废水或空气方面有广泛应用。HCHO中键角
,在处理含HCHO的废水或空气方面有广泛应用。HCHO中键角_______  中键角(填“大于”“小于”或“等于”)。原因是
中键角(填“大于”“小于”或“等于”)。原因是_______ 。
(1)基态氮原子价层电子排布图为
(2)基态Ni原子的电子排布式为
(3)基态Fe原子有
 的价层电子排布式为
的价层电子排布式为(4)C、N、O三种元素第一电离能从小到大的顺序为
(5)基态Ti原子核外电子排布的能量最高的能级符号是
(6)磷和砷是同一主族的元素,第一电离能:磷

 ,原因是
,原因是(7)已知第三电离能数据:
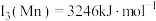 ,
,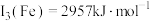 锰的第三电离能大于铁的第三电离能,其主要原因是
锰的第三电离能大于铁的第三电离能,其主要原因是(8)据报道,在
 的催化下,甲醛可被氧化成
的催化下,甲醛可被氧化成 ,在处理含HCHO的废水或空气方面有广泛应用。HCHO中键角
,在处理含HCHO的废水或空气方面有广泛应用。HCHO中键角 中键角(填“大于”“小于”或“等于”)。原因是
中键角(填“大于”“小于”或“等于”)。原因是
您最近一年使用:0次
4 . 下列说法正确的是
| A.在元素周期表中,s区、d区和ds区的元素都是金属 |
| B.在元素周期表中,每个纵列的价电子层的电子总数一定相等 |
C.某基态原子错误的核外电子排布图为 ,该排布图违背了泡利原理 ,该排布图违背了泡利原理 |
| D.“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,这一结论的理论是泡利原理 |
您最近一年使用:0次
5 . 已知下列电子排布图所表示的是元素的原子,其中能量处于最低状态的是
A.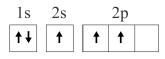 | B.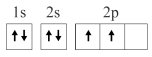 |
C.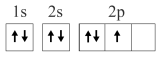 | D. |
您最近一年使用:0次
2021-05-28更新
|
1607次组卷
|
30卷引用:内蒙古通辽市开鲁县第一中学2021-2022学年高二下学期期中考试化学试题
内蒙古通辽市开鲁县第一中学2021-2022学年高二下学期期中考试化学试题云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期期中考试化学试题四川省自贡市富顺县城关中学2021-2022学年高一下学期期中考试化学试题(已下线)2014届四川省富顺一中高二上学期第一次月考化学试卷2015-2016学年湖北省黄冈市高二下期末化学试卷2016-2017学年山东省滨州市高二下学期第一次阶段性测试化学试卷人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2人教版2017-2018学年高二化学选修三同步训练:1.1 原子结构(第2课时)广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题云南省镇康县第一中学2019-2020学年高二12月月考化学试题云南省广南县第三中学校2019-2020学年高二上学期期末考试化学试题2020届高三化学二轮物质结构题型专攻—— 基态原子核外电子排布【选择基础专练】人教化学选修3第一章第一节课时3河南省林州市第一中学2019-2020学年高二4月月考(实验班)化学试题吉林省长春市第一中学2019-2020学年高二下学期阶段测试化学试题河南省洛阳市2019-2020学年高二下学期期末质量检测化学试题云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第一次月考化学试题甘肃省静宁县第一中学2020-2021学年高二上学期期末考试化学(实验班)试题吉林省通化县综合高级中学2019-2020学年高二下学期期末考试化学试题河北省石家庄市第十五中学2020-2021学年高二第二学期4月月考化学试题(已下线)作业01 原子结构-2021年高二化学暑假作业(人教版2019)(已下线)1.1.3 电子云与原子轨道 泡利原理与洪特规则 能量最低原理-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)1.1 原子结构(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第1.1.3讲 泡利原理、洪特规则、能量最低原理 -2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)河南省新乡市河南师范大学附属中学2021-2022学年高二下学期3月月考化学试题甘肃省高台县第一中学2021-2022学年高二下学期6月月考化学试题专题2 原子结构与元素性质 本专题复习提升1.1.3 泡利原理、洪特规则、能量最低原理-随堂练习
6 . 铁及其化合物是日常生活生产中应用广泛的材料,钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景。请回答下列问题:
(1)基态铁原子的价层电子的轨道表示式(电子排布图)为__ 。
(2)铁元素常见的离子有Fe2+和Fe3+两种,稳定性:Fe2+__ Fe3+ (填“强于”或“弱于”),原因是__ 。
(3)氮化钛熔点高,硬度大,具有典型的NaCl型晶体结构,其晶胞结构如图所示。
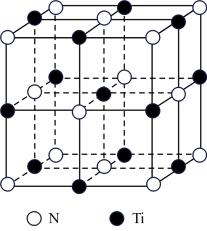
①设氮化钛晶体中Ti原子与跟它最邻近的N原子之间的距离为r,则晶胞内与该Ti原子最邻近的Ti原子的数目为__ ;Ti原子与跟它次邻近的N原子之间的距离为___ 。
②碳氮化钛化合物在汽车制造和航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为__ 。
(1)基态铁原子的价层电子的轨道表示式(电子排布图)为
(2)铁元素常见的离子有Fe2+和Fe3+两种,稳定性:Fe2+
(3)氮化钛熔点高,硬度大,具有典型的NaCl型晶体结构,其晶胞结构如图所示。

①设氮化钛晶体中Ti原子与跟它最邻近的N原子之间的距离为r,则晶胞内与该Ti原子最邻近的Ti原子的数目为
②碳氮化钛化合物在汽车制造和航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为
您最近一年使用:0次
2021-04-07更新
|
108次组卷
|
2卷引用:内蒙古赤峰第四中学2020-2021学年高二下学期期中考试化学试题
解题方法
7 . 有四种短周期元素,它们的结构、性质等信息如下表所示:
请根据表中信息填写:
(1)B原子的简化电子排布式_____ 。
(2)A元素在周期表中的位置_____ ;离子半径:A_____ B(填>、=或< )。
(3)E原子的价电子排布图是____ ,其原子核外有______ 个未成对电子,能量最高的电子为_____ 轨道上的电子,其轨道呈_____ 形。
(4)D原子的外围电子排布式为____ ,D-的离子结构示意图是_____ 。
(5)C、E元素的第一电离能的大小关系是_____ (用元素符号表示,下同)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是____ ,CD3的中心原子杂化轨道类型是___ ,CD3与水反应的化学方程式是_____ 。
| 元素 | 结构、性质等信息 |
| A | 是元素周期表中(除稀有气体外)原子半径最大的元素,该元素某种合金是原子反应堆导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
| E | L层上有2对成对电子 |
(1)B原子的简化电子排布式
(2)A元素在周期表中的位置
(3)E原子的价电子排布图是
(4)D原子的外围电子排布式为
(5)C、E元素的第一电离能的大小关系是
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是
您最近一年使用:0次
解题方法
8 . 下列电子排布式或轨道表示式正确的是( )
①C原子的轨道表示式:
②Cr原子的电子排布式:1s22s22p63s23p63d44s2
③O原子的轨道表示式:
④Br原子的外层电子排布式:3d104s24p5
⑤B原子的轨道表示式:
①C原子的轨道表示式:

②Cr原子的电子排布式:1s22s22p63s23p63d44s2
③O原子的轨道表示式:

④Br原子的外层电子排布式:3d104s24p5
⑤B原子的轨道表示式:

| A.① ② ③ | B.② ③ ④ | C.① ② ④ ⑤ | D.只有③ |
您最近一年使用:0次
名校
解题方法
9 . 现有七种元素A、B、C、D、E、F、G,其中A、B、C为三个不同周期的短周期元素,E、F、G为第四周期元素。请根据下列相关信息,回答问题。
(1)C基态原子中能量最高的电子,其电子云在空间有____ 个方向,原子轨道呈____ 形,C简单离子核外有___ 种运动状态不同的电子。
(2)①一般情况下,同种物质为固态时密度大于其液态,但固态A2B的密度比其液态时小,原因是___ ;
②A2B2难溶于CS2,简要说明理由:________ 。
(3)G位于____ 族___ 区,它的一种氧化物常用于工业生产硫酸的催化剂,已知G在该氧化物中的化合价等于其价电子数,则该氧化物的化学式为____ ;
(4)ED3分子的VSEPR模型名称为____ ,其中E原子的杂化轨道类型为____ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数与s电子数相等 |
| C基态原子的价电子排布为nsn-1npn+1 |
| D的能层数与C相同,且电负性比C大 |
| E元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第五列 |
(2)①一般情况下,同种物质为固态时密度大于其液态,但固态A2B的密度比其液态时小,原因是
②A2B2难溶于CS2,简要说明理由:
(3)G位于
(4)ED3分子的VSEPR模型名称为
您最近一年使用:0次
名校
10 . 在核电荷数为26的元素Fe的基态原子核外的3d、4s轨道内,下列电子排布图正确的是
A. | B. |
C. | D. |
您最近一年使用:0次
2019-05-11更新
|
654次组卷
|
14卷引用:内蒙古通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二下学期期中考试化学试题
内蒙古通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二下学期期中考试化学试题【全国百强校】山西省平遥中学校2018-2019学年高二下学期期中考试化学试题辽宁省阜新二高2020-2021学年高二下学期期中考试化学试题西藏林芝市第二高级中学2018-2019学年高二下学期期末考试理综化学试题四川省威远县龙会中学2019-2020学年高二12月月考化学试题山西省忻州市第二中学2019-2020高二下学期3月考试化学试题四川省射洪中学校2020-2021学年高二上学期第三次月考化学试题高二选择性必修2(人教版2019)第一章 原子结构与性质 第一节 原子结构 课时3 核外电子排布原理 电子排布图鲁科版2019选择性必修2第1章 原子结构与元素性质 第2节 原子结构与元素周期表 第1课时 基态原子的核外电子排布(人教版2019)选择性必修2第一章 原子结构与性质 第一节 原子结构 第4课时 泡利原理 洪特规则 能量最低原理安徽省滁州市定远县民族中学2021-2022学年高二下学期第一次教学检测化学试题海南省三亚华侨学校(南新校区)2020-2021学年高二下学期3月月考化学试jgh同黑龙江省伊春市伊美区第二中学2022-2023学年高二下学期期初考试化学试题1.1.3 泡利原理、洪特规则、能量最低原理-随堂练习



