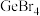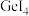1 . 下列表示不正确 的是
A.p能级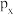 电子云轮廓图: 电子云轮廓图: |
B.用电子式表示 的形成过程: 的形成过程: |
C. 的名称:3-甲基戊烷 的名称:3-甲基戊烷 |
D.基态铬原子的价层电子轨道表示式: |
您最近一年使用:0次
名校
2 . 电池在人类生产生活中具有十分重要的作用,单晶硅和铜、锗、镓等的化合物常作为制备太阳能电池的原料。回答下列问题:
(1)基态镓原子的价层电子排布图是______ 。
(2)四氯化硅属于______ 晶体,硅原子的杂化方式是______ 。
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是______ 。
(4)比较键角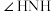 :
: 中的
中的
______  中的
中的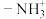 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由______ 。
(1)基态镓原子的价层电子排布图是
(2)四氯化硅属于
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是
|
|
| |
熔点 | -49.5 | 26 | 146 |
沸点 | 83.1 | 186 | 约400 |
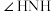 :
: 中的
中的
 中的
中的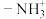 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由
您最近一年使用:0次
名校
3 . 下列化学用语表示不正确 的是
A.基态S原子价层电子轨道表示式: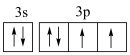 |
B. 分子的球棍模型: 分子的球棍模型: |
C. 的形成过程: 的形成过程: |
D.Fe的原子结构示意图: |
您最近一年使用:0次
名校
4 . 按要求回答下列问题
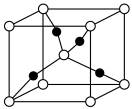
(1) 的晶胞形状为立方体,如图所示。
的晶胞形状为立方体,如图所示。___________ 。
②该晶胞中,每个Ca周围与它最近且相等距离的O有___________ 个。
③该晶胞结构的另一种表示中,Ti处于各顶角位置,则O处于___________ 位置。
(2)镓的卤化物都有较高的催化活性,可用于聚合和脱水等工艺,查得:
① 的熔点高于
的熔点高于 ,却远低于
,却远低于 ,原因是
,原因是___________ 。
②镓,锗元素及其化合物有许多用途。比较 ,
, 的键角:Cl-Ga-Cl
的键角:Cl-Ga-Cl___________ Cl-Ge-Cl(填“>”“<”或“=”)
(3) 晶体的晶胞结构如图,晶胞参数为anm,
晶体的晶胞结构如图,晶胞参数为anm, 的配位数
的配位数___________ 。该晶体密度的计算表达式为
___________  。
。
(1)
 的晶胞形状为立方体,如图所示。
的晶胞形状为立方体,如图所示。
②该晶胞中,每个Ca周围与它最近且相等距离的O有
③该晶胞结构的另一种表示中,Ti处于各顶角位置,则O处于
(2)镓的卤化物都有较高的催化活性,可用于聚合和脱水等工艺,查得:
| 物质 |  |  |  |
| 熔点/℃ | 124 | 78 | 1000 |
 的熔点高于
的熔点高于 ,却远低于
,却远低于 ,原因是
,原因是②镓,锗元素及其化合物有许多用途。比较
 ,
, 的键角:Cl-Ga-Cl
的键角:Cl-Ga-Cl(3)
 晶体的晶胞结构如图,晶胞参数为anm,
晶体的晶胞结构如图,晶胞参数为anm, 的配位数
的配位数
 。
。
您最近一年使用:0次
名校
解题方法
5 . 下列化学用语表示正确的是
A.18O2-离子结构示意图: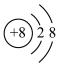 |
B.基态铜原子价电子的轨道表示式: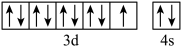 |
C. 的空间结构: 的空间结构: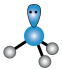 (三角锥形) (三角锥形) |
D.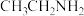 的化学名称:乙氨 的化学名称:乙氨 |
您最近一年使用:0次
2024-03-04更新
|
478次组卷
|
5卷引用:浙江省S9联盟2023-2024学年高二下学期4月期中考试化学试题
6 . 下列说法或有关化学用语的表达正确的是
A.能级能量大小关系: |
B.基态铜原子(29Cu)的价层电子排布式: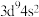 |
C. 处于激发态的电子排布式可能为: 处于激发态的电子排布式可能为: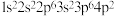 |
D.基态 的轨道表示式: 的轨道表示式: |
您最近一年使用:0次
2023-12-18更新
|
569次组卷
|
11卷引用:浙江省宁波市鄞州中学2023-2024学年高二上学期期中考试化学试卷
浙江省宁波市鄞州中学2023-2024学年高二上学期期中考试化学试卷浙江省嘉兴高级中学2023-2024学年高二上学期第二次教学调研(12月)化学试题(已下线)名校期中好题汇编-原子结构与性质(选择题)名校期中好题汇编-原子结构与性质(选择题)安徽省安庆市怀宁县高河中学2023-2024学年高二上学期第三次月考化学试题山东省济宁市微山县第二中学2023-2024学年高二上学期12月月考化学试题陕西省兴平市南郊高级中学2023-2024学年高二上学期第三次化学质量检测题广西钦州市第四中学2023-2024学年高二上学期12月考试化学试卷陕西省西安市周至县第四中学2023-2024学年高二上学期1月期末化学试题河南省洛阳偃师中成外国语学校2023-2024学年高二上学期12月月考化学试题(已下线)清单01 原子结构与性质(考点清单)(讲+练)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
22-23高二下·浙江·期中
解题方法
7 . 下列化学用语正确的是
A.二氧化碳电子式: | B.乙醛空间填充模型: |
| C.醋酸的结构简式:C2H4O2 | D.Cr2+价电子轨道表示式: |
您最近一年使用:0次
名校
8 . 回答下列问题:
(1)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10,失去1个电子需要的能量由大到小排序是_____ 。
(2)LiFePO4、LiPF6、LiAsF6、LiCl等常用于锂离子聚合物电池。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。

①PO 的空间构型是
的空间构型是______ ;Fe2+的价层电子轨道表示式是______ ,Fe2+的空间运动状态_____ 种。
②从化学键角度看,Li+迁移过程发生_____ (填“物理”或“化学”)变化。相同条件,Li+在_____ (选填“LiPF6”或“LiAsF6”)中迁移较快。
③抗坏血酸( )常被用作碳包覆的碳源,以增强电极导电性,该分子中碳原子的杂化方式为
)常被用作碳包覆的碳源,以增强电极导电性,该分子中碳原子的杂化方式为______ ;其易溶于水的原因是______ 。
(3)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为120°,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构和晶胞中碳原子的投影位置如图所示。

①该钛硅碳新型材料的化学式为______ 。
②已知该新型材料的摩尔质量为Mg/mol,密度为dg/cm3,阿伏加德罗常数的值用NA表示,则c为______ nm(用含字母的计算式表示)。
(1)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10,失去1个电子需要的能量由大到小排序是
(2)LiFePO4、LiPF6、LiAsF6、LiCl等常用于锂离子聚合物电池。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。

①PO
 的空间构型是
的空间构型是②从化学键角度看,Li+迁移过程发生
③抗坏血酸(
 )常被用作碳包覆的碳源,以增强电极导电性,该分子中碳原子的杂化方式为
)常被用作碳包覆的碳源,以增强电极导电性,该分子中碳原子的杂化方式为(3)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为120°,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构和晶胞中碳原子的投影位置如图所示。

①该钛硅碳新型材料的化学式为
②已知该新型材料的摩尔质量为Mg/mol,密度为dg/cm3,阿伏加德罗常数的值用NA表示,则c为
您最近一年使用:0次
22-23高二下·浙江·期中
解题方法
9 . 回答下列问题
(1)基态铜原子核外有___________ 种不同空间运动状态的电子;C、N、F、Cu四种元素第一电离能从小至大的顺序为___________ 。
(2)化合物 、
、 常温下均为气体,沸点较高的是
常温下均为气体,沸点较高的是___________ ; 中氮原子的杂化方式是
中氮原子的杂化方式是___________ 。
(3)将无水硫酸铜溶解在一定量的水中,再加入过量氨水,溶液变为深蓝色,该深蓝色离子。 内存在的化学键有
内存在的化学键有___________ 。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)基态Co的价电子排布图为___________ ,Co和Fe的逐级电离能(kJ/mol)如表,Fe的 大于Co的
大于Co的 原因是
原因是___________ 。
(1)基态铜原子核外有
(2)化合物
 、
、 常温下均为气体,沸点较高的是
常温下均为气体,沸点较高的是 中氮原子的杂化方式是
中氮原子的杂化方式是(3)将无水硫酸铜溶解在一定量的水中,再加入过量氨水,溶液变为深蓝色,该深蓝色离子。
 内存在的化学键有
内存在的化学键有A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)基态Co的价电子排布图为
 大于Co的
大于Co的 原因是
原因是| 元素 |  |  |  |  |  | … |
| Fe | 462.5 | 1561.9 | 2957 | 5290 | 7240 | |
| Co | 760.4 | 1648 | 3232 | 4950 | 7670 |
您最近一年使用:0次
22-23高二下·浙江·期中
10 . 下列说法不正确的是
A. 和 和 , , 和 和 分子中的键角相比均是前者大于后者 分子中的键角相比均是前者大于后者 |
B.基态C原子的轨道表示式 |
| C.N能层中有4s、4p、4d、4f四个能级,共16个轨道 |
D.25℃时,浓度均为 的3种溶液的酸性由强到弱的顺序: 的3种溶液的酸性由强到弱的顺序: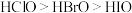 |
您最近一年使用:0次