1 . X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是
| A.原子半径:X>Y | B.简单氢化物的还原性:X>Y |
| C.同周期元素形成的单质中Y氧化性最强 | D.同周期中第一电离能小于X的元素有4种 |
您最近一年使用:0次
2021-06-29更新
|
13214次组卷
|
35卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时25 原子结构-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第36讲 原子结构与性质(精练)-2022年一轮复习讲练测(已下线)专题06 物质结构 元素周期律-备战2022年高考化学真题及地市好题专项集训【山东专用】江苏省如皋中学2021-2022学年高三上学期第一次阶段考试化学试题辽宁省渤海大学附属高级中学2021-2022学年高三上学期第二次月考化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期期中考试化学试题2021年湖北高考化学试题变式题11-192021年山东高考化学试题变式题1-10福建省福州第三中学2021-2022学年高三上学期第五次质量检测化学试题(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)浙江省温州新力量联盟2021-2022学年高二下学期期末联考化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)北京市清华大学附属中学2022-2023学年高三9月月考化学试题四川省遂宁市射洪中学2022-2023学年高二上学期第一次月考(10月)化学试题湖南省长沙市卓华高级中学2021-2022学年高二下学期期末考试化学试题四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题四川省遂宁中学校2022-2023学年高二上学期期中考试化学试题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破天津市第四十七中学2022—2023学年高三上学期期末 阶段性学习检测化学试题天津市第四十七中学2022-2023学年高三上学期期末考试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第27讲 元素周期表和元素周期律湖北省武汉市洪山高级中学2022-2023学年高二下学期2月考试化学试题安徽省安庆市第一中学2022-2023学年高二下学期第一次月考化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期第一次验收考试化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题1-5)(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
解题方法
2 . 寿山石被称为中华瑰宝,是中国传统四大印章石之一,其石质晶莹,脂润、色彩斑斓。色泽浑然天成。它主要由酸性火山凝灰岩经热液蚀变而成,化学式为 。回答下列问题:
。回答下列问题:
(1)下列状态的氧中,再失去一个电子所需要的能量最多的是_______(填字母)。
(2)硅可形成一系列硅氢化合物,但最长硅链长度远不及烃中碳链长度,原因是_______ , ……则该同系物中,含有n个硅原子的分子中,σ键数目为
……则该同系物中,含有n个硅原子的分子中,σ键数目为_______ (用含n的式子表示)。
(3)在硅酸盐中, 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式,图(b)为一种无限长单链结构单元的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式,图(b)为一种无限长单链结构单元的多硅酸根,其中Si原子的杂化形式为_______ ,化学式为_______ 。

(4) 具有强还原性,其晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,则
具有强还原性,其晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,则 的空间构型为
的空间构型为_______ ,①处的原子分数坐标是_______ ,用 表示阿伏加德罗常数,则
表示阿伏加德罗常数,则 晶体密度为
晶体密度为_______  。
。

 。回答下列问题:
。回答下列问题:(1)下列状态的氧中,再失去一个电子所需要的能量最多的是_______(填字母)。
A. | B. | C. | D. |
 ……则该同系物中,含有n个硅原子的分子中,σ键数目为
……则该同系物中,含有n个硅原子的分子中,σ键数目为(3)在硅酸盐中,
 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式,图(b)为一种无限长单链结构单元的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式,图(b)为一种无限长单链结构单元的多硅酸根,其中Si原子的杂化形式为
(4)
 具有强还原性,其晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,则
具有强还原性,其晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,则 的空间构型为
的空间构型为 表示阿伏加德罗常数,则
表示阿伏加德罗常数,则 晶体密度为
晶体密度为 。
。
您最近一年使用:0次
解题方法
3 . 短周期主族元素X、Y、Z、W的原子序数依次增大,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法错误的是( )
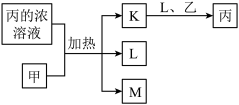

A.X、Y、Z三种元素的第一电离能: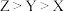 |
| B.X分别与Y、Z、W形成的分子中均可能含有非极性共价键 |
| C.Z元素的最高价含氧酸的酸性在同周期和同主族元素中均最强 |
D.若固体 是由直线形的 是由直线形的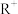 和平面三角形的 和平面三角形的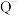 组成,则 组成,则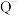 与丙溶液中的溶质阴离子相同 与丙溶液中的溶质阴离子相同 |
您最近一年使用:0次
2020-06-11更新
|
878次组卷
|
3卷引用:山东省日照市2020届高三校际联合考试(二模)化学试题
名校
4 . [化学-选修3:物质结构与性质]
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为____________ 。
(2)第四周期中,与铝未成对电子数相同的金属元素有________ 种。
(3)Na+和Ne互为等电子体,电离能I2(Na)________ I1(Ne)(填“>”或“<”)。
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
HClO4的结构简式为_________ ,HClO3中Cl原子的杂化轨道类型为________ ,HClO2中含有的共价键类型为__________ 。以上几种含氧酸的酸性强弱不同,其原因为______________ 。
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为_________ ,影响ΔH2递变的因素为______________ 。
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为________ g·cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为____________ 。
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为
(2)第四周期中,与铝未成对电子数相同的金属元素有
(3)Na+和Ne互为等电子体,电离能I2(Na)
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
HClO4的结构简式为
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为

(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为
您最近一年使用:0次
2017-03-23更新
|
487次组卷
|
3卷引用:福建省厦门市2017届高三下学期第一次质量检测理综化学试题
5 . 由多个单原子组成的“超级原子”具有单个原子不具有的化学性质,如 和
和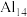 ,可与呈链形的碘分子发生反应,“超级原子”
,可与呈链形的碘分子发生反应,“超级原子” 会取代碘分子中的一个碘原子的位置,其他碘原子也“悬挂”在“超级原子”上,这种新的碘铝化合物既有金属铝的性质,又有非金属碘的性质,通常“超级原子”易形成最外层电子数之和为40的相对稳定状态。下列说法错误的是
会取代碘分子中的一个碘原子的位置,其他碘原子也“悬挂”在“超级原子”上,这种新的碘铝化合物既有金属铝的性质,又有非金属碘的性质,通常“超级原子”易形成最外层电子数之和为40的相对稳定状态。下列说法错误的是
 和
和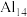 ,可与呈链形的碘分子发生反应,“超级原子”
,可与呈链形的碘分子发生反应,“超级原子” 会取代碘分子中的一个碘原子的位置,其他碘原子也“悬挂”在“超级原子”上,这种新的碘铝化合物既有金属铝的性质,又有非金属碘的性质,通常“超级原子”易形成最外层电子数之和为40的相对稳定状态。下列说法错误的是
会取代碘分子中的一个碘原子的位置,其他碘原子也“悬挂”在“超级原子”上,这种新的碘铝化合物既有金属铝的性质,又有非金属碘的性质,通常“超级原子”易形成最外层电子数之和为40的相对稳定状态。下列说法错误的是A. 具有氧化性, 具有氧化性,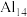 具有还原性 具有还原性 | B.Al的第一电离能比Mg小 |
C. 可与Mg形成 可与Mg形成 | D.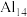 中的Al原子间通过离子键结合 中的Al原子间通过离子键结合 |
您最近一年使用:0次
2022-03-17更新
|
885次组卷
|
3卷引用:湖北省八市2021-2022学年下学期高三3月联考化学试题
解题方法
6 . 一定条件下用过量碱性 处理含有
处理含有 和
和 的混合溶液,得到一种镍银氧三元化合物,六方晶胞
的混合溶液,得到一种镍银氧三元化合物,六方晶胞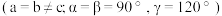 如图所示。回答下列问题:
如图所示。回答下列问题: 原子的价电子排布式为
原子的价电子排布式为______ ,镍原子的配位数为______ ,该制备反应的离子方程式为______ 。
(2)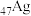 的第二电离能
的第二电离能______ (填“大于”或“小于”) 的第二电离能,原因是
的第二电离能,原因是______ 。
(3) 作催化剂,催化氧气氧化苯甲醇制备苯甲醛的化学方程式为
作催化剂,催化氧气氧化苯甲醇制备苯甲醛的化学方程式为______ ;相同条件下,苯甲醇在水中的溶解度大于苯甲醛的原因是______ 。
(4)若 键长为
键长为 夹角为
夹角为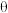 ,晶胞高为
,晶胞高为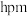 ,该化合物的摩尔质量为
,该化合物的摩尔质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则该化合物晶体的密度为
,则该化合物晶体的密度为______  (列出计算式即可)。
(列出计算式即可)。
 处理含有
处理含有 和
和 的混合溶液,得到一种镍银氧三元化合物,六方晶胞
的混合溶液,得到一种镍银氧三元化合物,六方晶胞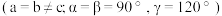 如图所示。回答下列问题:
如图所示。回答下列问题: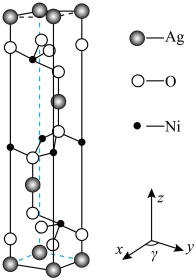
 原子的价电子排布式为
原子的价电子排布式为(2)
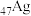 的第二电离能
的第二电离能 的第二电离能,原因是
的第二电离能,原因是(3)
 作催化剂,催化氧气氧化苯甲醇制备苯甲醛的化学方程式为
作催化剂,催化氧气氧化苯甲醇制备苯甲醛的化学方程式为(4)若
 键长为
键长为 夹角为
夹角为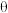 ,晶胞高为
,晶胞高为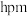 ,该化合物的摩尔质量为
,该化合物的摩尔质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则该化合物晶体的密度为
,则该化合物晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
7 . W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,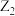 是氧化性最强的单质,4种元素可形成离子化合物
是氧化性最强的单质,4种元素可形成离子化合物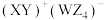 。下列说法正确的是
。下列说法正确的是
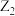 是氧化性最强的单质,4种元素可形成离子化合物
是氧化性最强的单质,4种元素可形成离子化合物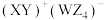 。下列说法正确的是
。下列说法正确的是| A.阴离子中含有配位键 | B.键能: |
| C.第一电离能:X<Y<Z | D.分子的极性: |
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题:
(1)人体内氧气的输送主要由红细胞内的血红蛋白负责,而红细胞以及血浆中还有少量的血蓝蛋白也能和氧气反应。用配体 离子和氧气能合成类似血监蛋白的模型配合物
离子和氧气能合成类似血监蛋白的模型配合物 ,该结构呈现出强烈的
,该结构呈现出强烈的 键断裂趋势,成键形态
键断裂趋势,成键形态 与断键形态
与断键形态 达成快速平衡。(
达成快速平衡。( 为异丙基)
为异丙基) 中
中 的化合价为
的化合价为___________ ,含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。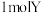 离子中通过螯合作用形成的配位键有
离子中通过螯合作用形成的配位键有___________  。
。
(2)非金属氮化物在生产、生活和科研中应用广泛。回答下列问题:
基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种; 第一电离能由大到小的顺序为
第一电离能由大到小的顺序为___________ 。
氟化硝酰 可用作火箭推进剂中的氧化剂,
可用作火箭推进剂中的氧化剂,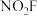 中心原子的杂化方式为
中心原子的杂化方式为___________ 。 分子为平面结构,
分子为平面结构, 分子为三角锥结构,
分子为三角锥结构, 中价层孤电子对占据
中价层孤电子对占据___________ 轨道, 碱性随
碱性随 原子电子云密度增大而增强,其中碱性强的是
原子电子云密度增大而增强,其中碱性强的是___________ ,原因为___________ 。
(4) 晶体晶胞组成结构单元(如图,部分原子未画出)
晶体晶胞组成结构单元(如图,部分原子未画出)___________
A.晶胞中与同一配体相连的两个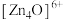 的不同之处在于排列方式或取向不同
的不同之处在于排列方式或取向不同
B. 晶体中
晶体中 的配位数为6
的配位数为6
C.已知 键长为
键长为 ,理论上图中
,理论上图中 两个
两个 之间的最短距离的计算式为
之间的最短距离的计算式为 。
。
D.已知 原子的分数坐标为
原子的分数坐标为 ,则
,则 原子的分数坐标
原子的分数坐标
②已知晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为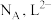 与
与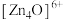 的相对分子质量分别为
的相对分子质量分别为 和
和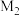 ,则
,则 的晶体密度为
的晶体密度为___________  (列出化简的计算式)。
(列出化简的计算式)。
(1)人体内氧气的输送主要由红细胞内的血红蛋白负责,而红细胞以及血浆中还有少量的血蓝蛋白也能和氧气反应。用配体
 离子和氧气能合成类似血监蛋白的模型配合物
离子和氧气能合成类似血监蛋白的模型配合物 ,该结构呈现出强烈的
,该结构呈现出强烈的 键断裂趋势,成键形态
键断裂趋势,成键形态 与断键形态
与断键形态 达成快速平衡。(
达成快速平衡。( 为异丙基)
为异丙基)
 中
中 的化合价为
的化合价为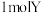 离子中通过螯合作用形成的配位键有
离子中通过螯合作用形成的配位键有 。
。(2)非金属氮化物在生产、生活和科研中应用广泛。回答下列问题:
基态
 原子核外电子的运动状态有
原子核外电子的运动状态有 第一电离能由大到小的顺序为
第一电离能由大到小的顺序为氟化硝酰
 可用作火箭推进剂中的氧化剂,
可用作火箭推进剂中的氧化剂,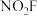 中心原子的杂化方式为
中心原子的杂化方式为气态 的分子结构为
的分子结构为 ,而固态
,而固态 则由一种直线型的阳离子
则由一种直线型的阳离子 与一种平面正三角形的阴离子
与一种平面正三角形的阴离子 构成,
构成, 的化学式为
的化学式为 的离域
的离域 键可表达为
键可表达为
 分子为平面结构,
分子为平面结构, 分子为三角锥结构,
分子为三角锥结构, 中价层孤电子对占据
中价层孤电子对占据 碱性随
碱性随 原子电子云密度增大而增强,其中碱性强的是
原子电子云密度增大而增强,其中碱性强的是(4)
 晶体晶胞组成结构单元(如图,部分原子未画出)
晶体晶胞组成结构单元(如图,部分原子未画出)
A.晶胞中与同一配体相连的两个
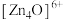 的不同之处在于排列方式或取向不同
的不同之处在于排列方式或取向不同B.
 晶体中
晶体中 的配位数为6
的配位数为6C.已知
 键长为
键长为 ,理论上图中
,理论上图中 两个
两个 之间的最短距离的计算式为
之间的最短距离的计算式为 。
。D.已知
 原子的分数坐标为
原子的分数坐标为 ,则
,则 原子的分数坐标
原子的分数坐标
②已知晶胞参数为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为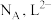 与
与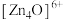 的相对分子质量分别为
的相对分子质量分别为 和
和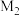 ,则
,则 的晶体密度为
的晶体密度为 (列出化简的计算式)。
(列出化简的计算式)。
您最近一年使用:0次
名校
解题方法
9 . 按要求回答下列问题
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为_______ 。
②在生成物中,A的电子式_______ ,含极性共价键的分子的中心原子轨道杂化类型为_______ 。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_______ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为_______ ,Q2+的未成对电子数是_______ 。
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为_______ 。
②H2Se的酸性比H2S_______ (填“强”或“弱”)。气态SeO3分子的价层电子对互斥模型为_______ ,SeO 离子中Se的杂化方式为
离子中Se的杂化方式为_______ 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______ 。
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为_______ 。
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S
 A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)①除S外,上列元素的电负性从大到小依次为
②在生成物中,A的电子式
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为
②H2Se的酸性比H2S
 离子中Se的杂化方式为
离子中Se的杂化方式为(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为
您最近一年使用:0次
名校
解题方法
10 . 氮和氮的相关化合物在很多领域有着广泛的应用。请回答:
I.搭载“神舟十一号”的长征-2F火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性。
(1)该物质中N原子的杂化方式为________ ,溶于水呈碱性的原因为___________ (用离子方程式表示)。
(2)氮元素的第一电离能比相邻的氧元素大,其原因为________________ 。
II.笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。
(3)预测N2O的结构式为________________ 。
(4)在短周期元素组成的物质中,写出与NO2-互为等电子体的分子_________ 。(写两个,填分子式)
III.氮化钛为金黄色晶体,有仿金效果,越来越多地成为黄金的代替品。

(5)Ti金属晶体的堆积模型为________ ,配位数为_______ ,基态Ti3+中未成对电子数有______ 个。
(6)氮化钛晶体的晶胞与NaCl晶胞相似(如图所示),该氮化钛的密度为ρg·cm-3,则该晶胞中N、Ti之间的最近距离为______ nm(NA为阿伏伽德罗常数的值,只列计算式)。该晶体中与氮原子距离相等且最近的钛原子围成的空间几何体为____________________ 。
I.搭载“神舟十一号”的长征-2F火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性。
(1)该物质中N原子的杂化方式为
(2)氮元素的第一电离能比相邻的氧元素大,其原因为
II.笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。
(3)预测N2O的结构式为
(4)在短周期元素组成的物质中,写出与NO2-互为等电子体的分子
III.氮化钛为金黄色晶体,有仿金效果,越来越多地成为黄金的代替品。

(5)Ti金属晶体的堆积模型为
(6)氮化钛晶体的晶胞与NaCl晶胞相似(如图所示),该氮化钛的密度为ρg·cm-3,则该晶胞中N、Ti之间的最近距离为
您最近一年使用:0次
2019-02-13更新
|
816次组卷
|
2卷引用:【全国百强校】河南省南阳市第一中学2019届高三第九次考试理综化学试题



