名校
解题方法
1 . 铊的相关信息卡片如图所示:
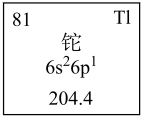
(1)铊的原子序数为81,铊在元素周期表中位置_______ 。
(2)根据所学知识,下列推断正确的是_______ 。
(3)铊(Tl)是某超导材料的组成元素之一。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+。下列推断正确的是_______ 。
(4)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。表中列出了第三周期的几种元素的部分性质:请按要求回答下列问题:
①写出基态a原子的价层电子轨道表示式:_______ 。
②预测X值的范围:_______ <X<_______ 。
③表中五种元素的第一电离能由大到小排第二的是_______ (写元素符号)。
(5)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂、钛酸锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
①基态Ti原子的核外电子排布式为:_______ 。
②基态Fe3+、Fe2+离子中未成对的电子数之比为_______ 。
③元素Li为_______ 区元素。

(1)铊的原子序数为81,铊在元素周期表中位置
(2)根据所学知识,下列推断正确的是
| A.单质的还原性:Tl>Al | B.原子半径:Al>Tl |
| C.碱性:Al(OH)3>Tl(OH)3 | D.氧化性:Tl3+>Al3+ |
| A.Tl+最外层有1个电子 | B.Tl能形成+3价和+1价的化合物 |
C.Tl3+的氧化性比 弱 弱 | D.Tl+的还原性比Ag强 |
| 元素编号 | a | b | c | d | e |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
①写出基态a原子的价层电子轨道表示式:
②预测X值的范围:
③表中五种元素的第一电离能由大到小排第二的是
(5)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂、钛酸锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
①基态Ti原子的核外电子排布式为:
②基态Fe3+、Fe2+离子中未成对的电子数之比为
③元素Li为
您最近一年使用:0次
2 . X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是
| A.原子半径:X>Y | B.简单氢化物的还原性:X>Y |
| C.同周期元素形成的单质中Y氧化性最强 | D.同周期中第一电离能小于X的元素有4种 |
您最近一年使用:0次
2021-06-29更新
|
12954次组卷
|
35卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时25 原子结构-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第36讲 原子结构与性质(精练)-2022年一轮复习讲练测(已下线)专题06 物质结构 元素周期律-备战2022年高考化学真题及地市好题专项集训【山东专用】江苏省如皋中学2021-2022学年高三上学期第一次阶段考试化学试题辽宁省渤海大学附属高级中学2021-2022学年高三上学期第二次月考化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期期中考试化学试题2021年湖北高考化学试题变式题11-192021年山东高考化学试题变式题1-10福建省福州第三中学2021-2022学年高三上学期第五次质量检测化学试题(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)浙江省温州新力量联盟2021-2022学年高二下学期期末联考化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)北京市清华大学附属中学2022-2023学年高三9月月考化学试题四川省遂宁市射洪中学2022-2023学年高二上学期第一次月考(10月)化学试题湖南省长沙市卓华高级中学2021-2022学年高二下学期期末考试化学试题四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题四川省遂宁中学校2022-2023学年高二上学期期中考试化学试题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破天津市第四十七中学2022—2023学年高三上学期期末 阶段性学习检测化学试题天津市第四十七中学2022-2023学年高三上学期期末考试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第27讲 元素周期表和元素周期律湖北省武汉市洪山高级中学2022-2023学年高二下学期2月考试化学试题安徽省安庆市第一中学2022-2023学年高二下学期第一次月考化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期第一次验收考试化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题1-5)(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
解题方法
3 . 寿山石被称为中华瑰宝,是中国传统四大印章石之一,其石质晶莹,脂润、色彩斑斓。色泽浑然天成。它主要由酸性火山凝灰岩经热液蚀变而成,化学式为 。回答下列问题:
。回答下列问题:
(1)下列状态的氧中,再失去一个电子所需要的能量最多的是_______(填字母)。
(2)硅可形成一系列硅氢化合物,但最长硅链长度远不及烃中碳链长度,原因是_______ , ……则该同系物中,含有n个硅原子的分子中,σ键数目为
……则该同系物中,含有n个硅原子的分子中,σ键数目为_______ (用含n的式子表示)。
(3)在硅酸盐中, 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式,图(b)为一种无限长单链结构单元的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式,图(b)为一种无限长单链结构单元的多硅酸根,其中Si原子的杂化形式为_______ ,化学式为_______ 。

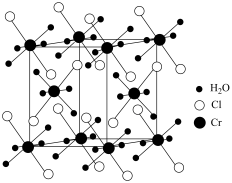
(4) 具有强还原性,其晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,则
具有强还原性,其晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,则 的空间构型为
的空间构型为_______ ,①处的原子分数坐标是_______ ,用 表示阿伏加德罗常数,则
表示阿伏加德罗常数,则 晶体密度为
晶体密度为_______  。
。

 。回答下列问题:
。回答下列问题:(1)下列状态的氧中,再失去一个电子所需要的能量最多的是_______(填字母)。
A. | B. | C. | D. |
 ……则该同系物中,含有n个硅原子的分子中,σ键数目为
……则该同系物中,含有n个硅原子的分子中,σ键数目为(3)在硅酸盐中,
 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式,图(b)为一种无限长单链结构单元的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式,图(b)为一种无限长单链结构单元的多硅酸根,其中Si原子的杂化形式为
(4)
 具有强还原性,其晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,则
具有强还原性,其晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,则 的空间构型为
的空间构型为 表示阿伏加德罗常数,则
表示阿伏加德罗常数,则 晶体密度为
晶体密度为 。
。
您最近一年使用:0次
4 . X、Y、Z、W是同周期主族元素,四种元素均是短周期元素,W元素形成的某种单质具有强氧化性,可用于杀菌消毒。四种元素与锂组成的盐是一种新型锂离子电池的电解质,结构如图所示,下列说法正确的是
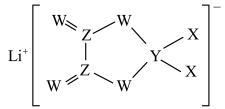

| A.组成这种新型电解质的所有元素均处于元素周期表p区 |
| B.Z元素的含氧酸不可能使酸性高锰酸钾溶液褪色 |
| C.最简单氢化物的沸点: X>W |
| D.同周期中第一电离能比W元素小的有4种元素 |
您最近一年使用:0次
解题方法
5 . 短周期主族元素X、Y、Z、W的原子序数依次增大,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法错误的是( )
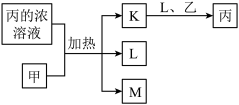

A.X、Y、Z三种元素的第一电离能: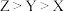 |
| B.X分别与Y、Z、W形成的分子中均可能含有非极性共价键 |
| C.Z元素的最高价含氧酸的酸性在同周期和同主族元素中均最强 |
D.若固体 是由直线形的 是由直线形的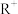 和平面三角形的 和平面三角形的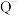 组成,则 组成,则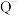 与丙溶液中的溶质阴离子相同 与丙溶液中的溶质阴离子相同 |
您最近一年使用:0次
2020-06-11更新
|
873次组卷
|
3卷引用:山东省日照市2020届高三校际联合考试(二模)化学试题
名校
6 . [化学-选修3:物质结构与性质]
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为____________ 。
(2)第四周期中,与铝未成对电子数相同的金属元素有________ 种。
(3)Na+和Ne互为等电子体,电离能I2(Na)________ I1(Ne)(填“>”或“<”)。
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
HClO4的结构简式为_________ ,HClO3中Cl原子的杂化轨道类型为________ ,HClO2中含有的共价键类型为__________ 。以上几种含氧酸的酸性强弱不同,其原因为______________ 。
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为_________ ,影响ΔH2递变的因素为______________ 。
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为________ g·cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为____________ 。
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为
(2)第四周期中,与铝未成对电子数相同的金属元素有
(3)Na+和Ne互为等电子体,电离能I2(Na)
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
HClO4的结构简式为
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为

(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为
您最近一年使用:0次
2017-03-23更新
|
487次组卷
|
3卷引用:福建省厦门市2017届高三下学期第一次质量检测理综化学试题
7 . 由多个单原子组成的“超级原子”具有单个原子不具有的化学性质,如 和
和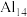 ,可与呈链形的碘分子发生反应,“超级原子”
,可与呈链形的碘分子发生反应,“超级原子” 会取代碘分子中的一个碘原子的位置,其他碘原子也“悬挂”在“超级原子”上,这种新的碘铝化合物既有金属铝的性质,又有非金属碘的性质,通常“超级原子”易形成最外层电子数之和为40的相对稳定状态。下列说法错误的是
会取代碘分子中的一个碘原子的位置,其他碘原子也“悬挂”在“超级原子”上,这种新的碘铝化合物既有金属铝的性质,又有非金属碘的性质,通常“超级原子”易形成最外层电子数之和为40的相对稳定状态。下列说法错误的是
 和
和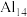 ,可与呈链形的碘分子发生反应,“超级原子”
,可与呈链形的碘分子发生反应,“超级原子” 会取代碘分子中的一个碘原子的位置,其他碘原子也“悬挂”在“超级原子”上,这种新的碘铝化合物既有金属铝的性质,又有非金属碘的性质,通常“超级原子”易形成最外层电子数之和为40的相对稳定状态。下列说法错误的是
会取代碘分子中的一个碘原子的位置,其他碘原子也“悬挂”在“超级原子”上,这种新的碘铝化合物既有金属铝的性质,又有非金属碘的性质,通常“超级原子”易形成最外层电子数之和为40的相对稳定状态。下列说法错误的是A. 具有氧化性, 具有氧化性,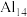 具有还原性 具有还原性 | B.Al的第一电离能比Mg小 |
C. 可与Mg形成 可与Mg形成 | D.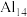 中的Al原子间通过离子键结合 中的Al原子间通过离子键结合 |
您最近一年使用:0次
2022-03-17更新
|
881次组卷
|
3卷引用:湖北省八市2021-2022学年下学期高三3月联考化学试题
真题
解题方法
8 . 氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角 中的
中的
_______  中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: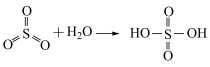
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: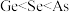 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为 中的
中的
 中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
解题方法
9 . 铁、铜、硒是人体必须的微量元素,对于三种元素形成的化合物科学家有深入的研究。
I.
(1)氧、硫、硒是同主族元素,三种元素电负性由大到小的顺序为______ (填元素符号)。
(2)请写出氧、硫、硒三种元素的最简单氢化物中沸点最高的物质,并说明理由:_______ 。
(3)亚硒酸是一种有毒的物质,有还原性,亚硒酸中阴离子的空间构型为___________ 。
II.常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们的晶胞具有相同的侧视图如图2所示。已知CuS的晶胞参数为apm。

(4)基态Cu+比Cu2+稳定的原因是___________ 。
(5)CuS晶体中,相邻的两个铜离子间的距离为___________ pm。
(6)Cu2S晶体中,S2-的配位数为___________ 。
III.铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。

(7)δ-Fe晶胞中含有___________ 个铁原子。
(8)α-Fe晶体的空间利用率为___________ 。
(9)已知γ-Fe晶胞中铁原子的半径为r,则γ-Fe晶胞的体积是___________ 。
I.
(1)氧、硫、硒是同主族元素,三种元素电负性由大到小的顺序为
(2)请写出氧、硫、硒三种元素的最简单氢化物中沸点最高的物质,并说明理由:
(3)亚硒酸是一种有毒的物质,有还原性,亚硒酸中阴离子的空间构型为
II.常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们的晶胞具有相同的侧视图如图2所示。已知CuS的晶胞参数为apm。

(4)基态Cu+比Cu2+稳定的原因是
(5)CuS晶体中,相邻的两个铜离子间的距离为
(6)Cu2S晶体中,S2-的配位数为
III.铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。

(7)δ-Fe晶胞中含有
(8)α-Fe晶体的空间利用率为
(9)已知γ-Fe晶胞中铁原子的半径为r,则γ-Fe晶胞的体积是
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题:
(1)人体内氧气的输送主要由红细胞内的血红蛋白负责,而红细胞以及血浆中还有少量的血蓝蛋白也能和氧气反应。用配体 离子和氧气能合成类似血监蛋白的模型配合物
离子和氧气能合成类似血监蛋白的模型配合物 ,该结构呈现出强烈的
,该结构呈现出强烈的 键断裂趋势,成键形态
键断裂趋势,成键形态 与断键形态
与断键形态 达成快速平衡。(
达成快速平衡。( 为异丙基)
为异丙基) 中
中 的化合价为
的化合价为___________ ,含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。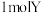 离子中通过螯合作用形成的配位键有
离子中通过螯合作用形成的配位键有___________  。
。
(2)非金属氮化物在生产、生活和科研中应用广泛。回答下列问题:
基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种; 第一电离能由大到小的顺序为
第一电离能由大到小的顺序为___________ 。
氟化硝酰 可用作火箭推进剂中的氧化剂,
可用作火箭推进剂中的氧化剂,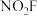 中心原子的杂化方式为
中心原子的杂化方式为___________ 。 分子为平面结构,
分子为平面结构, 分子为三角锥结构,
分子为三角锥结构, 中价层孤电子对占据
中价层孤电子对占据___________ 轨道, 碱性随
碱性随 原子电子云密度增大而增强,其中碱性强的是
原子电子云密度增大而增强,其中碱性强的是___________ ,原因为___________ 。
(4) 晶体晶胞组成结构单元(如图,部分原子未画出)
晶体晶胞组成结构单元(如图,部分原子未画出)___________
A.晶胞中与同一配体相连的两个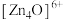 的不同之处在于排列方式或取向不同
的不同之处在于排列方式或取向不同
B. 晶体中
晶体中 的配位数为6
的配位数为6
C.已知 键长为
键长为 ,理论上图中
,理论上图中 两个
两个 之间的最短距离的计算式为
之间的最短距离的计算式为 。
。
D.已知 原子的分数坐标为
原子的分数坐标为 ,则
,则 原子的分数坐标
原子的分数坐标
②已知晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为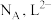 与
与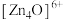 的相对分子质量分别为
的相对分子质量分别为 和
和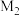 ,则
,则 的晶体密度为
的晶体密度为___________  (列出化简的计算式)。
(列出化简的计算式)。
(1)人体内氧气的输送主要由红细胞内的血红蛋白负责,而红细胞以及血浆中还有少量的血蓝蛋白也能和氧气反应。用配体
 离子和氧气能合成类似血监蛋白的模型配合物
离子和氧气能合成类似血监蛋白的模型配合物 ,该结构呈现出强烈的
,该结构呈现出强烈的 键断裂趋势,成键形态
键断裂趋势,成键形态 与断键形态
与断键形态 达成快速平衡。(
达成快速平衡。( 为异丙基)
为异丙基)
 中
中 的化合价为
的化合价为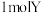 离子中通过螯合作用形成的配位键有
离子中通过螯合作用形成的配位键有 。
。(2)非金属氮化物在生产、生活和科研中应用广泛。回答下列问题:
基态
 原子核外电子的运动状态有
原子核外电子的运动状态有 第一电离能由大到小的顺序为
第一电离能由大到小的顺序为氟化硝酰
 可用作火箭推进剂中的氧化剂,
可用作火箭推进剂中的氧化剂,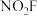 中心原子的杂化方式为
中心原子的杂化方式为气态 的分子结构为
的分子结构为 ,而固态
,而固态 则由一种直线型的阳离子
则由一种直线型的阳离子 与一种平面正三角形的阴离子
与一种平面正三角形的阴离子 构成,
构成, 的化学式为
的化学式为 的离域
的离域 键可表达为
键可表达为
 分子为平面结构,
分子为平面结构, 分子为三角锥结构,
分子为三角锥结构, 中价层孤电子对占据
中价层孤电子对占据 碱性随
碱性随 原子电子云密度增大而增强,其中碱性强的是
原子电子云密度增大而增强,其中碱性强的是(4)
 晶体晶胞组成结构单元(如图,部分原子未画出)
晶体晶胞组成结构单元(如图,部分原子未画出)
A.晶胞中与同一配体相连的两个
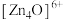 的不同之处在于排列方式或取向不同
的不同之处在于排列方式或取向不同B.
 晶体中
晶体中 的配位数为6
的配位数为6C.已知
 键长为
键长为 ,理论上图中
,理论上图中 两个
两个 之间的最短距离的计算式为
之间的最短距离的计算式为 。
。D.已知
 原子的分数坐标为
原子的分数坐标为 ,则
,则 原子的分数坐标
原子的分数坐标
②已知晶胞参数为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为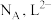 与
与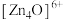 的相对分子质量分别为
的相对分子质量分别为 和
和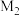 ,则
,则 的晶体密度为
的晶体密度为 (列出化简的计算式)。
(列出化简的计算式)。
您最近一年使用:0次



