解题方法
1 . 硅、硒、铜、镍及其化合物在生产和生活中有着广泛的应用。请回答下列问题:
(1)基态硅原子中电子占据最高能级的电子云轮廓图的形状为_______ (用文字表述)。
(2)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、② 、③
、③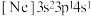 ,有关这些微粒的叙述,正确的是_______。
,有关这些微粒的叙述,正确的是_______。
(3)在硅酸盐中,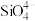 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为_______ 。
_______  (填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠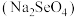 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。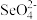 的空间结构为
的空间结构为_______ 。
(5)在周期表中Cu与Ni位置相邻,但两种金属元素的第二电离能为I2(Cu)>I2(Ni),其原因是_______ 。
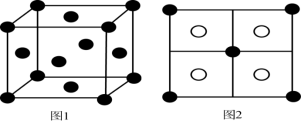
(6)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心。它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为 。
。_______ 。Cu2S晶体的密度为_______ g·cm-3(列出计算式即可)。
(1)基态硅原子中电子占据最高能级的电子云轮廓图的形状为
(2)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、② 、③
、③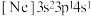 ,有关这些微粒的叙述,正确的是_______。
,有关这些微粒的叙述,正确的是_______。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
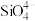 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为

 (填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠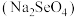 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。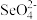 的空间结构为
的空间结构为(5)在周期表中Cu与Ni位置相邻,但两种金属元素的第二电离能为I2(Cu)>I2(Ni),其原因是
(6)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心。它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为
 。
。
您最近一年使用:0次
名校
2 . 2021年5月,中国第一辆火星车“祝融号成功登陆火星。探测发现火星上存在大量橄榄石矿物( )。回答下列问题:
)。回答下列问题:
1.基态Fe原子的价电子排布式为___________ 。橄榄石中,铁元素的化合价为___________ ,所含各主族元素电负性由大到小的顺序为___________ 。
2.用一个方程式表示Na与Mg金属性的相对强弱___________ 。
3.基态氧原子的轨道表示式为___________ ,其2p能级的未成对电子具有不同的___________ (填选项)。
A.能量 B.电子云的形状 C.自旋状态 D.电子云的伸展方向
4.已知NaCl熔点为800.7℃, 熔点为-68.8℃,Na与Si均为第三周期元素,NaCl熔点明显高于
熔点为-68.8℃,Na与Si均为第三周期元素,NaCl熔点明显高于 ,原因是
,原因是___________ 。 的空间结构为
的空间结构为___________ ,Si原子的杂化方式是___________ 。
5.由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]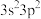 ②[Ne]
②[Ne]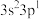 ③[Ne]
③[Ne] ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
6.X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的2s轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法错误的是___________。
 )。回答下列问题:
)。回答下列问题:1.基态Fe原子的价电子排布式为
2.用一个方程式表示Na与Mg金属性的相对强弱
3.基态氧原子的轨道表示式为
A.能量 B.电子云的形状 C.自旋状态 D.电子云的伸展方向
4.已知NaCl熔点为800.7℃,
 熔点为-68.8℃,Na与Si均为第三周期元素,NaCl熔点明显高于
熔点为-68.8℃,Na与Si均为第三周期元素,NaCl熔点明显高于 ,原因是
,原因是 的空间结构为
的空间结构为5.由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]
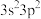 ②[Ne]
②[Ne]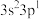 ③[Ne]
③[Ne] ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>②>① | B.电子排布属于基态原子的是:①③ |
| C.电离出一个电子所需能量:②>①>③ | D.得电子能力:①>② |
| A.电负性:Z>X |
| B.最高正价:Z<M |
| C.Q与M的化合物中可能含有非极性共价键 |
| D.最高价氧化物对应水化物的酸性:Z>Y |
您最近一年使用:0次
名校
3 . 氢叠氮酸(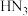 )属于叠氮化物,是一种弱酸,其酸性类似于醋酸,能微弱电离出
)属于叠氮化物,是一种弱酸,其酸性类似于醋酸,能微弱电离出 和
和 。分子结构示意图如图所示。回答下列问题:
。分子结构示意图如图所示。回答下列问题:

(1)下列有关说法正确的是___________(填字母符号)。
(2)叠氮酸根可作为一种配体,在 中钴显
中钴显___________ 价,基态钴原子的价电子排布式为___________ 。 空间形状为
空间形状为___________ 。
(3) 与
与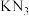 结构类似,前者熔点比后者
结构类似,前者熔点比后者___________ (填“大”或“小”), 中氮原子的第一电离能比氧原子
中氮原子的第一电离能比氧原子___________ (填“大”或“小”)。
(4)人造立方氮化硼是超硬材料,其晶胞如图所示。

①晶体中硼原子的配位数为___________ 。
②设该晶体的摩尔质量为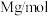 ,晶体的密度为ρ
,晶体的密度为ρ ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体中的距离最近的硼原子之间的距离为
,则晶体中的距离最近的硼原子之间的距离为___________ cm。
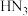 )属于叠氮化物,是一种弱酸,其酸性类似于醋酸,能微弱电离出
)属于叠氮化物,是一种弱酸,其酸性类似于醋酸,能微弱电离出 和
和 。分子结构示意图如图所示。回答下列问题:
。分子结构示意图如图所示。回答下列问题:
(1)下列有关说法正确的是___________(填字母符号)。
A.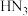 中含有5个 中含有5个 键 键 | B.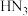 中三个氮原子采用的都是sp2杂化 中三个氮原子采用的都是sp2杂化 |
C.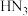 、 、 都是极性分子 都是极性分子 | D.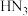 、 、 、 、 分子间都可以形成氢键 分子间都可以形成氢键 |
 中钴显
中钴显 空间形状为
空间形状为(3)
 与
与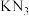 结构类似,前者熔点比后者
结构类似,前者熔点比后者 中氮原子的第一电离能比氧原子
中氮原子的第一电离能比氧原子(4)人造立方氮化硼是超硬材料,其晶胞如图所示。

①晶体中硼原子的配位数为
②设该晶体的摩尔质量为
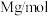 ,晶体的密度为ρ
,晶体的密度为ρ ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体中的距离最近的硼原子之间的距离为
,则晶体中的距离最近的硼原子之间的距离为
您最近一年使用:0次
解题方法
4 . N、P、As及其化合物在工农业生产中用途非常广泛。回答下列问题:
(1)写出基态N原子的核外电子排布式___________ , 与N同周期的主族元素中,第一电离能比N大的元素是___________ (填元素符号) 。
(2)NH3是制造HNO3、化肥、炸药的重要原料,还可用于制冷。NH3的立体构型为___________ , 在工业合成NH3 (N2 + 3H2 2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为
2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为___________ , 原因是___________ 。
(3)H3PO2是一种重要的化工原料。已知:无机含氧酸分子中非羟基氧越多,酸性越强。1个非羟基氧是中强酸,2个非羟基氧是强酸。如H3PO4为中强酸,其结构简式为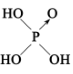 ;H3PO2也是一种中强酸,则H3PO2的结构简式为
;H3PO2也是一种中强酸,则H3PO2的结构简式为___________ ,写出H3PO2与足量NaOH溶液反应的化学方程式____________ 。
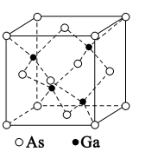
(4)GaAs 的熔点为1 238 °C,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为___________ 。已知:阿伏加德罗常数的值为NA,GaAs的摩尔质量为145g·mol-1,则GaAs的晶胞边长为___________ pm。
(1)写出基态N原子的核外电子排布式
(2)NH3是制造HNO3、化肥、炸药的重要原料,还可用于制冷。NH3的立体构型为
 2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为
2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为(3)H3PO2是一种重要的化工原料。已知:无机含氧酸分子中非羟基氧越多,酸性越强。1个非羟基氧是中强酸,2个非羟基氧是强酸。如H3PO4为中强酸,其结构简式为
 ;H3PO2也是一种中强酸,则H3PO2的结构简式为
;H3PO2也是一种中强酸,则H3PO2的结构简式为(4)GaAs 的熔点为1 238 °C,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为

您最近一年使用:0次
名校
解题方法
5 . 硒( )被科学家称为人体微量元素中的“抗癌之王”,硒(
)被科学家称为人体微量元素中的“抗癌之王”,硒( )与氧(O)、硫(S)位于元素周期表中第ⅥA族。回答下列问题:
)与氧(O)、硫(S)位于元素周期表中第ⅥA族。回答下列问题:
(1)基态氧原子的价电子排布图为___________ ,第二周期元素的第一电离能比氧元素大的主族元素有___________ (填元素符号)。
(2)单质硫最稳定的结构是由八个原子组成的环——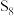 ,其中S原子的杂化方式为
,其中S原子的杂化方式为___________ 。
(3)酸性: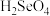
___________ 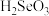 (填“强于”或“弱于”),
(填“强于”或“弱于”),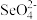 的空间构型为
的空间构型为___________ ,写出一种与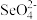 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:___________ 。
(4) 、
、 均为离子化合物,其熔点由高到低的顺序为
均为离子化合物,其熔点由高到低的顺序为___________ (用化学式表示),原因为___________ 。
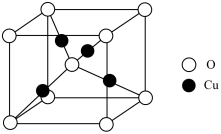
(5) 的立方晶胞结构如图所示,晶胞参数为
的立方晶胞结构如图所示,晶胞参数为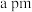 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 )被科学家称为人体微量元素中的“抗癌之王”,硒(
)被科学家称为人体微量元素中的“抗癌之王”,硒( )与氧(O)、硫(S)位于元素周期表中第ⅥA族。回答下列问题:
)与氧(O)、硫(S)位于元素周期表中第ⅥA族。回答下列问题:(1)基态氧原子的价电子排布图为
(2)单质硫最稳定的结构是由八个原子组成的环——
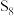 ,其中S原子的杂化方式为
,其中S原子的杂化方式为(3)酸性:
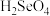
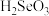 (填“强于”或“弱于”),
(填“强于”或“弱于”),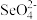 的空间构型为
的空间构型为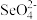 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:(4)
 、
、 均为离子化合物,其熔点由高到低的顺序为
均为离子化合物,其熔点由高到低的顺序为(5)
 的立方晶胞结构如图所示,晶胞参数为
的立方晶胞结构如图所示,晶胞参数为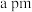 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
6 . 饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)⇌2 (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷在元素周期表中的位置为_______ ;AsH3的电子式为______ ;
(2)下列说法正确的是_________ ;
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.第一电离能:S<P<As
(3)沉淀X为__________ (填化学式);
(4)“一级沉砷”中FeSO4的作用是________ 。
(5)“二级沉砷”中H2O2与含砷物质反应的化学方程式为__________ ;
(6)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________ 。

已知:①As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)⇌2
 (aq);
(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷在元素周期表中的位置为
(2)下列说法正确的是
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.第一电离能:S<P<As
(3)沉淀X为
(4)“一级沉砷”中FeSO4的作用是
(5)“二级沉砷”中H2O2与含砷物质反应的化学方程式为
(6)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成
 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 含钴化合物在机械制造、磁性材料等领域具有广泛的应用,请回答下列问题:
(1)基态Co3+的价电子排布图为____ 。
(2)钴的配合物[Co(NH3)5Br](NO3)2
①第一电离能N_____ O(填“大于”、“小于”或“不能确定”);两种配位原子的杂化轨道类型均为____ ;
②钴离子周围配位键数目(配位数)是___ ;N03-的空间构型为____ ;
③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是____ 。
(3)某钴氧化物晶体具有CoO2的层状结构如下图所示(小球表示Co,大球表示O)。下列用粗线面出的结构单元不能描述CoO2)的化学组成的是_____

(4)Co的另一种氧化物的晶胞如图,已知钴原子的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,钴原子填在氧原子的___ 填“正八面体”、“正四面体”或“立方体”)空隙;钴原子与跟它次近邻的氧原子之间的距离为____ ;在该钴的氧化物晶体中原子的空间利用率为____ (均用含a、b的计算表达式表示)。

(1)基态Co3+的价电子排布图为
(2)钴的配合物[Co(NH3)5Br](NO3)2
①第一电离能N
②钴离子周围配位键数目(配位数)是
③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是
(3)某钴氧化物晶体具有CoO2的层状结构如下图所示(小球表示Co,大球表示O)。下列用粗线面出的结构单元不能描述CoO2)的化学组成的是

(4)Co的另一种氧化物的晶胞如图,已知钴原子的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,钴原子填在氧原子的

您最近一年使用:0次
2018-03-29更新
|
460次组卷
|
2卷引用:四川省广安、眉山、内江、遂宁2018届高三第二次诊断性考试理综化学试题
8 . VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
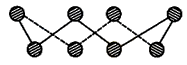
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______ ;_______________ ;
(3)Se原子序数为_______ ,其核外M层电子的排布式为___________________ ;
(4)H2Se的酸性比H2S_________ (填“强”或“弱”)。气态SeO3分子的立体构型为______________ ,SO32-离子的立体构型为___________________ ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:_____________________________________ ;
② H2SeO4比 H2SeO3酸性强的原因:______________________________________________________________
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是
(3)Se原子序数为
(4)H2Se的酸性比H2S
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
② H2SeO4比 H2SeO3酸性强的原因:
您最近一年使用:0次
2016-12-09更新
|
587次组卷
|
3卷引用:2015-2016学年广东汕头金山中学高二下第十二周练化学卷
名校
解题方法
9 . VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
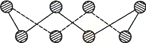
(1) S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______ ;
(2) 原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为________________ ;
(3) Se原子序数为______ ,其核外M层电子的排布式为______ ;
(4) H2Se的酸性比H2S__________ (填“强”或“弱”)。气态SeO3分子的立体构型为______ ,SO32-离子的立体构型为______ ;
(5) H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,
K2为1.2×10-2,请根据结构与性质的关系解释:
① H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:__________ ;
② H2SeO4比H2SeO3酸性强的原因:______ ;
(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
① H、C、N、O四种元素的电负性由小到大的顺序为_______________________ 。
② 与CNO-互为等电子体微粒的化学式为_________________ (写出一种即可)。
③ 氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式________________ 。
(7)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H―→Rx[CrCln(H2O)6-n]+xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为___
(1) S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是
(2) 原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
(3) Se原子序数为
(4) H2Se的酸性比H2S
(5) H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,
K2为1.2×10-2,请根据结构与性质的关系解释:
① H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
② H2SeO4比H2SeO3酸性强的原因:
(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
① H、C、N、O四种元素的电负性由小到大的顺序为
② 与CNO-互为等电子体微粒的化学式为
③ 氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式
(7)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H―→Rx[CrCln(H2O)6-n]+xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为
您最近一年使用:0次



