名校
解题方法
1 . 乙二胺四乙酸铁钠可用于感光材料冲洗药品及漂白剂,化学式为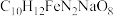 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下:
(1)基态氯原子的价层电子排布图为___________ 。
(2)下列氮原子能量最高的是___________(填标号)。
(3)EDTA的组成元素中C、N、O的第一电离能由大到小顺序为___________ (填元素符号)。碳原子的杂化轨道类型为___________ 。
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为___________ 。
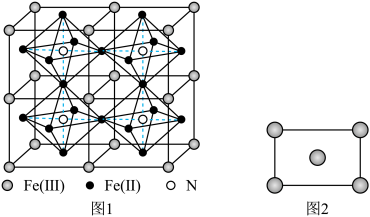
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为___________ 。___________ 区(填“s”“p”“d”或“ds”)。铁的某种晶胞沿面对角线的位置切下之后可以得到如图2所示的截面。假设铁的原子半径为a nm,则该铁晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
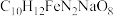 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下: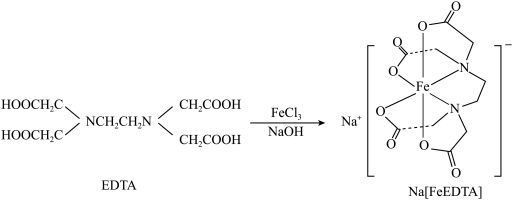
(1)基态氯原子的价层电子排布图为
(2)下列氮原子能量最高的是___________(填标号)。
A.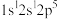 | B. | C. | D.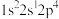 |
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-04-23更新
|
875次组卷
|
8卷引用:福建省百校联盟2023届高三第三次模拟考试化学试题
福建省百校联盟2023届高三第三次模拟考试化学试题福建省百校联盟2023届高三下学期第三次模拟考试化学试题(已下线)押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)广西壮族自治区南宁市第二中学2023届高三下学期收网考理科综合化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)北京市第二中学2022-2023学年高二下学期期末考试化学试题北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学
名校
解题方法
2 . 前四周期元素X、Y、Z、Q、W、R原子序数依次增大,Y、Z、Q位于同一周期,X与Z能构成4核18电子分子,化合物甲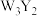 和乙
和乙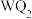 均为离子化合物,W的s电子数和p电子数相等,R是前四周期元素中未成对电子最多的元素,请回答下列有关问题。
均为离子化合物,W的s电子数和p电子数相等,R是前四周期元素中未成对电子最多的元素,请回答下列有关问题。
(1)R在元素周期表中的位置是_______ 。
(2)写出化合物甲的电子式_______ ,化合物甲与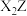 反应的化学方程式为
反应的化学方程式为_______ (用元素符号进行回答,下同) 。
(3)Y、Z、Q三种元素的第一电离能从大到小的顺序是_______ ;Z、Q两元素电负性大小顺序为_______ 。
(4)物质丙、丁、戊、己是由X、Y、Z、Q中的部分元素组成的二元化合物,丙、丁、戊三种分子中电子数相同,单质a和单质b是上述元素构成的单质,上述物质有如下图转化关系。
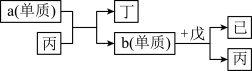
①丁与戊反应生成的化合物中存在的化学键类型是_______ 。
②b单质与戊反应的化学方程式为:_______ 。
(5)元素R的逐级电离能如下表:
R元素在化合物中常表现为+6价,试结合原子结构从电离能角度解释其原因_______ ;
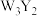 和乙
和乙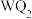 均为离子化合物,W的s电子数和p电子数相等,R是前四周期元素中未成对电子最多的元素,请回答下列有关问题。
均为离子化合物,W的s电子数和p电子数相等,R是前四周期元素中未成对电子最多的元素,请回答下列有关问题。(1)R在元素周期表中的位置是
(2)写出化合物甲的电子式
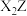 反应的化学方程式为
反应的化学方程式为(3)Y、Z、Q三种元素的第一电离能从大到小的顺序是
(4)物质丙、丁、戊、己是由X、Y、Z、Q中的部分元素组成的二元化合物,丙、丁、戊三种分子中电子数相同,单质a和单质b是上述元素构成的单质,上述物质有如下图转化关系。

①丁与戊反应生成的化合物中存在的化学键类型是
②b单质与戊反应的化学方程式为:
(5)元素R的逐级电离能如下表:
| 电离能 | I1 | I2 | I3 | I4 | I5 | I6 | I7 |
 | 652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
您最近一年使用:0次
解题方法
3 . 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:________ (填字母)。
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为________ ,电负性Si________ H(填“>”或“<”)。
②该反应的化学方程式为________ 。
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:________ 。
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
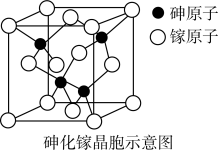
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
(4)写出基态Ga原子价层电子排布式________ 。
(5)As的第一电离能比Se大的主要原因是:________________ 。
(6)下图为砷化镓晶胞示意图,写出其化学式________ 。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:
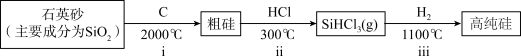
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为
②该反应的化学方程式为
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
| Si | |||
| Ga | As | Se |
(4)写出基态Ga原子价层电子排布式
(5)As的第一电离能比Se大的主要原因是:
(6)下图为砷化镓晶胞示意图,写出其化学式
您最近一年使用:0次
4 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。 、Ⅱ
、Ⅱ 元素属于
元素属于___________ 区。
②2017年5月9日我国发布了113号 、115号
、115号 、117号
、117号 、118号
、118号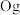 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期Ⅴ 族
族
b.117号元素 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中“
的信息,其中“ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ 。
②前四周期同族元素的某种性质 随核电荷数的变化趋势如图所示,则下列说法正确的是
随核电荷数的变化趋势如图所示,则下列说法正确的是___________ (填字母)。 、
、 、
、 表示氧族元素,则
表示氧族元素,则 表示对应氢化物的稳定性
表示对应氢化物的稳定性
B.若 、
、 、
、 表示卤族元素,则
表示卤族元素,则 表示对应简单离子的还原性
表示对应简单离子的还原性
C.若 、
、 、
、 表示第Ⅰ
表示第Ⅰ 族元素,则
族元素,则 表示对应离子的氧化性
表示对应离子的氧化性
D.若 、
、 、
、 表示第Ⅱ
表示第Ⅱ 族元素,则
族元素,则 表示最高价氧化物对应水化物的碱性
表示最高价氧化物对应水化物的碱性

 、Ⅱ
、Ⅱ 元素属于
元素属于②2017年5月9日我国发布了113号
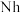 、115号
、115号 、117号
、117号 、118号
、118号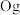 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期Ⅴ
 族
族b.117号元素
 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中“
的信息,其中“ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:

 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是②前四周期同族元素的某种性质
 随核电荷数的变化趋势如图所示,则下列说法正确的是
随核电荷数的变化趋势如图所示,则下列说法正确的是
 、
、 、
、 表示氧族元素,则
表示氧族元素,则 表示对应氢化物的稳定性
表示对应氢化物的稳定性B.若
 、
、 、
、 表示卤族元素,则
表示卤族元素,则 表示对应简单离子的还原性
表示对应简单离子的还原性C.若
 、
、 、
、 表示第Ⅰ
表示第Ⅰ 族元素,则
族元素,则 表示对应离子的氧化性
表示对应离子的氧化性D.若
 、
、 、
、 表示第Ⅱ
表示第Ⅱ 族元素,则
族元素,则 表示最高价氧化物对应水化物的碱性
表示最高价氧化物对应水化物的碱性
您最近一年使用:0次
名校
解题方法
5 . 已知A、B、C、D、E、F为原子序数依次增大的前36号元素,A的一种同位素原子无中子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D的基态原子2p轨道中含有两种不同自旋方向的电子,且电子数之比为3:1;E为短周期中电负性最小的元素;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。含有Y元素的某种钙盐是漂白粉的有效成分。Z元素正三价阳离子的3d轨道为半充满状态。用于回答下列问题(用元素符号或化学式表示):
(1)F在元素周期表中位置为___________ 区。基态原子与F元素同周期且最外层电子数相等元素还有___________ (填元素符号)。元素Z与F的第二电离能 的原因是
的原因是___________ 。
(2)D和E可形成一种既含有共价键又含有离子键的化合物,该化合物的电子式为___________ 。
(3)比较B、C、D最简单气态氢化物的稳定性大到小顺序为:___________ (用分子式表示)。
(4) 分子可与
分子可与 离子结合成
离子结合成 离子,这个过程中发生改变是
离子,这个过程中发生改变是___________ 。(填字母)。
a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角 d.微粒的电子数
(5)某F与Y形成的化合物的晶胞如图所示(黑点代表F原子)。___________ 。
②已知该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中F原子和Y原子之间的最短距离为
,则该晶体中F原子和Y原子之间的最短距离为___________ cm(只写计算式)(F原子位于体对角线上)。
(6)E的一种晶体如图甲、乙所示,若按甲虚线方向切乙得到的截面图是___________(填字母)。
(1)F在元素周期表中位置为
 的原因是
的原因是(2)D和E可形成一种既含有共价键又含有离子键的化合物,该化合物的电子式为
(3)比较B、C、D最简单气态氢化物的稳定性大到小顺序为:
(4)
 分子可与
分子可与 离子结合成
离子结合成 离子,这个过程中发生改变是
离子,这个过程中发生改变是a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角 d.微粒的电子数
(5)某F与Y形成的化合物的晶胞如图所示(黑点代表F原子)。

②已知该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中F原子和Y原子之间的最短距离为
,则该晶体中F原子和Y原子之间的最短距离为(6)E的一种晶体如图甲、乙所示,若按甲虚线方向切乙得到的截面图是___________(填字母)。

A.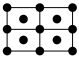 | B.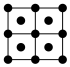 | C.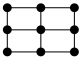 | D. |
您最近一年使用:0次
解题方法
6 . 研究发现, 氧化物负载的M氧化物纳米粒子和
氧化物负载的M氧化物纳米粒子和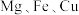 等元素纳米粒子催化剂在合成淀粉过程中有较高的催化活性。以
等元素纳米粒子催化剂在合成淀粉过程中有较高的催化活性。以 和
和 为主要原料人工合成淀粉涉及的部分反应如下:
为主要原料人工合成淀粉涉及的部分反应如下:
反应i: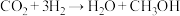
反应ii: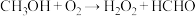
(1) 在元素周期表中的位置为
在元素周期表中的位置为_______ ,基态 原子核外电子占据的最高能级的原子轨道形状为
原子核外电子占据的最高能级的原子轨道形状为_______ 。
(2)第一电离能: ,其原因是
,其原因是_______ 。
(3)反应ii中, 中π键的形成方式为
中π键的形成方式为_______ (填“肩并肩”或“头碰头”), 的同素异形体
的同素异形体 为
为_______ (填“极性”或“非极性”)分子。
(4)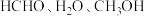 三者的沸点从高到低的顺序为
三者的沸点从高到低的顺序为_______ ,原因是_______ 。
(5) 具有
具有 型结构(如图),
型结构(如图), 的配位数为
的配位数为_______ ;已知 的晶胞参数
的晶胞参数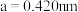 ,则
,则 的半径为
的半径为_______ 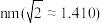 。
。
 氧化物负载的M氧化物纳米粒子和
氧化物负载的M氧化物纳米粒子和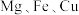 等元素纳米粒子催化剂在合成淀粉过程中有较高的催化活性。以
等元素纳米粒子催化剂在合成淀粉过程中有较高的催化活性。以 和
和 为主要原料人工合成淀粉涉及的部分反应如下:
为主要原料人工合成淀粉涉及的部分反应如下:反应i:
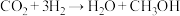
反应ii:
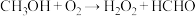
(1)
 在元素周期表中的位置为
在元素周期表中的位置为 原子核外电子占据的最高能级的原子轨道形状为
原子核外电子占据的最高能级的原子轨道形状为(2)第一电离能:
 ,其原因是
,其原因是(3)反应ii中,
 中π键的形成方式为
中π键的形成方式为 的同素异形体
的同素异形体 为
为(4)
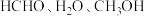 三者的沸点从高到低的顺序为
三者的沸点从高到低的顺序为(5)
 具有
具有 型结构(如图),
型结构(如图), 的配位数为
的配位数为 的晶胞参数
的晶胞参数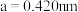 ,则
,则 的半径为
的半径为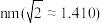 。
。
您最近一年使用:0次
名校
解题方法
7 . 含氯物质在生产、生活中有重要作用。工业上常用次氯酸钠处理含有 NO 等氮氧化物的尾气,反应方程式如下:NaClO + NO + H2O — NaCl + HNO3 (未配平)。
(1)氯在元素周期表中的位置是_______ ,其所在主族的元素中,最高价氧化物对应的水化物酸性最强的是_______ (填化学式)。其所在周期的元素中,第一电离能最大的是______ (填化学式)。
(2)配平上述反应方程式_______ 。每有 0.3mol 电子发生转移,可消耗标准状况下 NO 气体的体积约为______ L。
(3)NaClO 溶液中存在如下关系:c(OH-)_____ c(HClO)(填“>”、“=”、或“<”)。
其他条件相同,随着 NaClO 溶液初始 pH(用稀硫酸调节)的不同,NO 转化率如图。
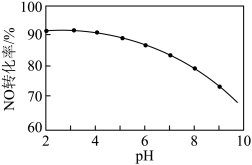
(4)NaClO 溶液的初始pH 越大,NO 的转化率越________ (填“高”或“低”),其原因是_________ 。
(5)取少量 NaClO 溶液和 KClO3 溶液,分别置于 A 试管和 B 试管,滴加试剂,观察现象,记录于下表。请将表格填写完整。
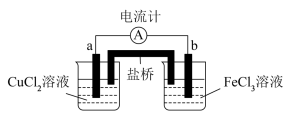
(6)某化学学习小组设计原电池装置如下图 (a 为铜电极 b 为石墨电极) :,请写出负极的电极反应式________ ;盐桥在原电池中所起的作用(任意写出一条)__________ 。
(1)氯在元素周期表中的位置是
(2)配平上述反应方程式
(3)NaClO 溶液中存在如下关系:c(OH-)
其他条件相同,随着 NaClO 溶液初始 pH(用稀硫酸调节)的不同,NO 转化率如图。

(4)NaClO 溶液的初始pH 越大,NO 的转化率越
(5)取少量 NaClO 溶液和 KClO3 溶液,分别置于 A 试管和 B 试管,滴加试剂,观察现象,记录于下表。请将表格填写完整。
| 滴加 KI 溶液 | 再滴加 CCl4,振荡、静置 | 结论 | |
| A 试管 | 溶液变为棕黄色 | 溶液分层,下层显 | 氧化性强弱:(填“>”或“<”) KClO3 |
| B 试管 | 无现象 | 溶液分层,均无色 |
(6)某化学学习小组设计原电池装置如下图 (a 为铜电极 b 为石墨电极) :,请写出负极的电极反应式

您最近一年使用:0次
8 . 如下图所示,分别是前三周期主族元素原子半径与第一电离能的关系曲线。回答下列问题:
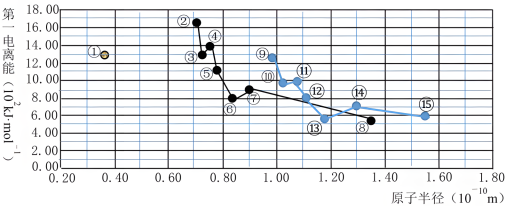
(1)图中编号为①⑥⑨的元素的元素符号分别是________ 、________ 、________ 。
(2)编号为⑮的元素原子的基态核外电子排布式为________ 。编号为⑬的元素原子的价层电子轨道表示式为________ 。元素②③⑭⑮对应的最简单离子半径由大到小的顺序为________ (用离子符号表示)。
(3)编号为⑨的元素在元素周期表中的位置为________ ,由它的原子和编号为⑮的元素的原子形成化合物的过程,用电子式可表示为________ 。
(4)由编号为①④⑤三种元素组成的一种结构式为 的物质,其中Y元素的化合价为
的物质,其中Y元素的化合价为________ 。该物质的电子式是________ 。

(1)图中编号为①⑥⑨的元素的元素符号分别是
(2)编号为⑮的元素原子的基态核外电子排布式为
(3)编号为⑨的元素在元素周期表中的位置为
(4)由编号为①④⑤三种元素组成的一种结构式为
 的物质,其中Y元素的化合价为
的物质,其中Y元素的化合价为
您最近一年使用:0次
名校
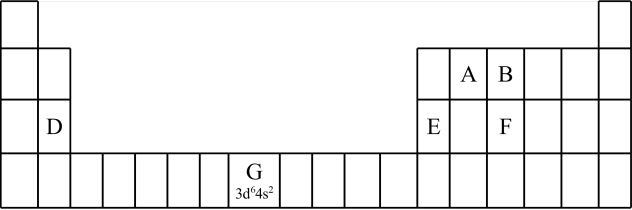
9 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
(1)认识元素周期表的结构:___________ 区。
②2017年5月9日我国发布了113号 、115号
、115号 、117号
、117号 、118号
、118号 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期 族
族
b.117号元素 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D_______ E(填“>” “<”或“=”)。
②气态氢化物的沸点:B_____ F (填“>”“<”或“=”),理由是___________ 。B的另一种氢化物可以作为火箭推进剂的燃料之一,其电子式为___________ 。
(1)认识元素周期表的结构:
②2017年5月9日我国发布了113号
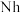 、115号
、115号 、117号
、117号 、118号
、118号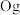 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期
 族
族b.117号元素
 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
2024-04-26更新
|
57次组卷
|
2卷引用:安徽省淮南第二中学2023-2024学年高二下学期期中测试化学试题
10 . W、X、Y、Z为同一周期的四种主族元素,原子序数依次增大。基态Y原子的价电子排布为3s23p4,X的电离能数据如下表所示。
(1)基态X原子的电子排布式_____ ,X在元素周期表中的位置是_____ ,_____ 区。
(2)用电子式表示WZ的形成过程:_____ 。
(3)下列事实能用元素周期律解释的是_____ (填字母序号)。
a.W可用于制备活泼金属钾
b.Y的气态氢化物的稳定性小于H2O
c.将Z单质通入Na2S溶液中,溶液变浑浊
d.Y的氧化物对应的水化物H2YO3的酸性比H2SiO3强
(4)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为M(OH)n,该水化物中的M-O-H结构有两种断键方式,断M-O键在水中电离出OH-,断O-H键则在水中电离出H+。
ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物的M-O-H结构中,成键原子电负性差异越大,所成化学键越容易断裂。
①已知:O、H元素的电负性数值分别为3.5和2.1,若元素M的电负性数值为2.5,且电负性差异是影响M-O-H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈_____ (填“酸”或“碱”)性,依据是_____ 。
②W和X的最高价氧化物对应的水化物中,碱性较强的是_____ (写化学式),结合资料说明理由:_____ 。
| 电离能 | I1 | I2 | I3 | I4 | … |
| Ia/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | … |
(2)用电子式表示WZ的形成过程:
(3)下列事实能用元素周期律解释的是
a.W可用于制备活泼金属钾
b.Y的气态氢化物的稳定性小于H2O
c.将Z单质通入Na2S溶液中,溶液变浑浊
d.Y的氧化物对应的水化物H2YO3的酸性比H2SiO3强
(4)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为M(OH)n,该水化物中的M-O-H结构有两种断键方式,断M-O键在水中电离出OH-,断O-H键则在水中电离出H+。
ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物的M-O-H结构中,成键原子电负性差异越大,所成化学键越容易断裂。
①已知:O、H元素的电负性数值分别为3.5和2.1,若元素M的电负性数值为2.5,且电负性差异是影响M-O-H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈
②W和X的最高价氧化物对应的水化物中,碱性较强的是
您最近一年使用:0次



