名校
解题方法
1 . 过渡元素在现代工农业生产和科技发展方面具有重要的用途。回答下列问题:
(1)已知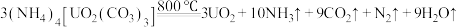 。
。
①基态U原子的外围电子排布式为 ,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是
,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是___________ (填标号)。
A. B.
B. 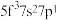 C.
C. 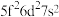 D.
D. 
②反应中断裂的化学键有___________ (填标号)。
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
③反应所得的气态产物中属于非极性分子的是___________ (填化学式,下同);氢化物中更易与 形成配离子的是
形成配离子的是___________ 。向 溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式
溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式___________ 。
(2)一个配体中有两个配位原子的配体叫双齿配体,C2O 就是一种双齿配体。Fe3+的配位数是6,硫酸铁溶液中加入H2C2O4后生成配离子的化学式为
就是一种双齿配体。Fe3+的配位数是6,硫酸铁溶液中加入H2C2O4后生成配离子的化学式为___________
(3)四羰基镍 是制备铂镍合金的重要原料之一,
是制备铂镍合金的重要原料之一, 为无色有挥发性的剧毒液体,呈四面体构型。熔点25℃,沸点42℃。四羰基镍的晶体类型是
为无色有挥发性的剧毒液体,呈四面体构型。熔点25℃,沸点42℃。四羰基镍的晶体类型是___________ 。
(4)铑掺杂SrTiO3形成的催化剂,在光催化CO2还原反应中有很高的催化效率。SrTiO3的晶胞结构如图所示。其中Sr2+位于晶胞的体心,当有1%的Ti4+被Rh3+替代后,晶体中会失去部分O2-产生缺陷,此时平均每个晶胞所含O2-数目为___________ (保留三位小数)。

(1)已知
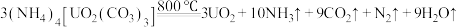 。
。①基态U原子的外围电子排布式为
 ,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是
,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是A.
 B.
B. 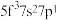 C.
C. 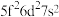 D.
D. 
②反应中断裂的化学键有
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
③反应所得的气态产物中属于非极性分子的是
 形成配离子的是
形成配离子的是 溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式
溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式(2)一个配体中有两个配位原子的配体叫双齿配体,C2O
 就是一种双齿配体。Fe3+的配位数是6,硫酸铁溶液中加入H2C2O4后生成配离子的化学式为
就是一种双齿配体。Fe3+的配位数是6,硫酸铁溶液中加入H2C2O4后生成配离子的化学式为(3)四羰基镍
 是制备铂镍合金的重要原料之一,
是制备铂镍合金的重要原料之一, 为无色有挥发性的剧毒液体,呈四面体构型。熔点25℃,沸点42℃。四羰基镍的晶体类型是
为无色有挥发性的剧毒液体,呈四面体构型。熔点25℃,沸点42℃。四羰基镍的晶体类型是(4)铑掺杂SrTiO3形成的催化剂,在光催化CO2还原反应中有很高的催化效率。SrTiO3的晶胞结构如图所示。其中Sr2+位于晶胞的体心,当有1%的Ti4+被Rh3+替代后,晶体中会失去部分O2-产生缺陷,此时平均每个晶胞所含O2-数目为

您最近一年使用:0次
2024-04-03更新
|
271次组卷
|
2卷引用:山东省济宁市第一中学2023-2024学年高三下学期3月月考化学试题
名校
解题方法
2 . 物质的光学性质在科研中有重要的用途。回答下列问题:
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:___________ ,M中键角F-B-F___________  中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为___________ 。
(2)均为平面结构的吡咯(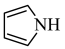 )和吡啶(
)和吡啶(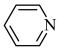 )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为___________ ,原因是___________ 。
Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。 的配位数为
的配位数为___________ ,阴离子形成的八面体空隙有___________ 个。
(4)该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为___________ nm。
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
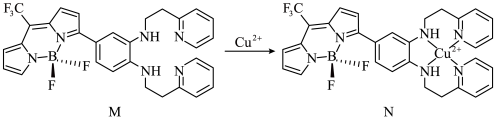
 中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。
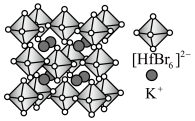
 的配位数为
的配位数为(4)该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为
您最近一年使用:0次
2024-03-14更新
|
1139次组卷
|
4卷引用:山东省烟台市2024届高三一模化学试题
山东省烟台市2024届高三一模化学试题2024届山东省高三下学期第一次练兵考试一模化学试题山东省德州市2023-2024学年高三下学期一模考试化学试题(已下线)化学(山东卷03)-2024年高考押题预测卷
名校
解题方法
3 . 卤族元素及其化合物种类繁多,有着非常重要的用途,回答下列问题:
(1)基态Br原子的电子排布式为[Ar]____ 。
(2)HF分子的极性____ (填“大于”“等于”或“小于”,以下同)HCl,同一条件下,HF在水中的溶解度____ HCl,HF的沸点____ HCl。SOCl2中心S原子VSEPR模型为____ 。1mol氟硼酸铵NH4BF4中含有____ mol配位键。
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为( ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为____ ,距离Hg最近的Ag有____ 个。设NA为阿伏加德罗常数的值,Ag2HgI4的摩尔质量为Mg•mol-1,该晶体的密度为____ g•cm-3(用代数式表示)。

(1)基态Br原子的电子排布式为[Ar]
(2)HF分子的极性
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为(
 ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为
您最近一年使用:0次
2022-03-22更新
|
1241次组卷
|
3卷引用:山东省济南市2022届高三3月高考模拟考试(一模)化学试题
2021·全国·模拟预测
名校
解题方法
4 . 氮(N)、磷(P)、砷(As)等第VA族元素的单质和化合物在科研与生产中有许多重要用途。回答下列问题:
(1)基态砷原子的价电子排布图为_______ ,电负性:As_______ S(填“>”“=”或“<”)。
(2)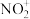 中N原子的杂化方式是
中N原子的杂化方式是_______ 杂化。
(3)LiFePO4、聚乙二醇、LiPF6、LiAsF6和LiCl等可作锂离子聚合物电池的材料。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。

①从化学键角度看,Li+迁移过程发生_______ (填“物理”或“化学”)变化。
②相同条件,电池材料_______ (填“LiPF6”或“LiAsF6”)中的Li+迁移较快,原因是_______ 。
(4)通常认为Cu3N是离子晶体,其晶格能可通过Born−Haber循环计算得到。
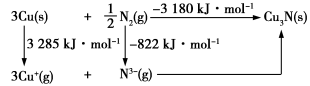
通过图中数据_______ (填“能”或“不能”)计算出Cu原子的第一电离能,Cu3N晶格能为_______ kJ·mol−1。
(5)PCl5能形成离子型晶体,该晶体的晶胞如图所示:
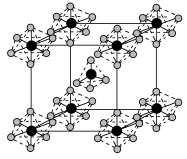
其阴离子中P的配位数为_______ ;若立方体的晶胞边长为apm,NA为阿伏加德罗常数的值,则该晶体的密度为_______ g·cm−3。
(1)基态砷原子的价电子排布图为
(2)
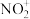 中N原子的杂化方式是
中N原子的杂化方式是(3)LiFePO4、聚乙二醇、LiPF6、LiAsF6和LiCl等可作锂离子聚合物电池的材料。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。

①从化学键角度看,Li+迁移过程发生
②相同条件,电池材料
(4)通常认为Cu3N是离子晶体,其晶格能可通过Born−Haber循环计算得到。
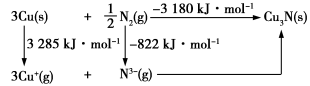
通过图中数据
(5)PCl5能形成离子型晶体,该晶体的晶胞如图所示:

其阴离子中P的配位数为
您最近一年使用:0次



