名校
1 . X、Y、Z、W为原子序数依次增大的短周期元素,基态Y原子的s能级电子数是p能级的2倍,基态W原子的电子总数是其最高能级电子数的2倍,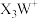 是10电子微粒,可形成离子液体
是10电子微粒,可形成离子液体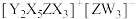 。下列说法正确的是
。下列说法正确的是
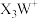 是10电子微粒,可形成离子液体
是10电子微粒,可形成离子液体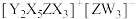 。下列说法正确的是
。下列说法正确的是| A.第一电离能:Y<W<Z | B. 与 与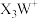 的空间结构相同 的空间结构相同 |
C.键能: | D. 中存在 中存在 键、氢键和配位键 键、氢键和配位键 |
您最近一年使用:0次
2024-03-21更新
|
916次组卷
|
3卷引用:山东省淄博市2024届高三一模化学试题
山东省淄博市2024届高三一模化学试题(已下线)题型5 物质结构与性质 有机物的结构与性质(25题)-2024年高考化学常考点必杀300题(新高考通用)四川省射洪中学校2023-2024学年高二下学期4月月考化学试题
名校
解题方法
2 . 铁的配合物在生产、生活中有重要应用,某种铁的配合物结构如图所示,下列说法正确的是
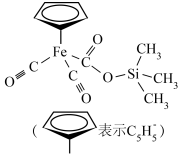

| A.基态硅原子最高能级轨道形状为球形 |
| B.该配合物中碳原子的杂化方式有2种 |
| C.该配合物中元素的电负性最大的是氧 |
| D.基态铁原子核外电子有26种空间运动状态 |
您最近一年使用:0次
解题方法
3 . 铁、镍、铜、钇( )在医药、催化及材料等领域中应用广泛。回答下列问题:
)在医药、催化及材料等领域中应用广泛。回答下列问题:
(1) 在元素周期表中的位置为
在元素周期表中的位置为________ ,第二周期中基态原子末成对电子数与 相同且电负性最小的元素是
相同且电负性最小的元素是___________ (填元素符号)。
(2)一种某铁的配合物结构如图所示。该物质中不含有的化学键类型是________ (填标号)。

A.离子键 B.配位键 C.非极性共价键 D. 键 E.
键 E. 键
键
在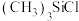 、
、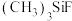 、
、 分子中,
分子中,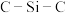 键角最大的是
键角最大的是________ 。
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。
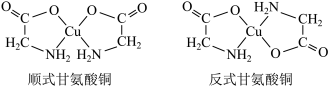
甘氨酸铜中铜原子的杂化类型为___________ (填“ ”或“
”或“ ”);
”);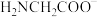 能与
能与 形成稳定的环状化合物,其原因是
形成稳定的环状化合物,其原因是___________ ;顺式甘氨酸铜在水中溶解度远大于反式甘氨酸铜,主要原因是___________ 。
(4)铁酸钇的正交相晶胞结构以及各原子的投影如图所示。
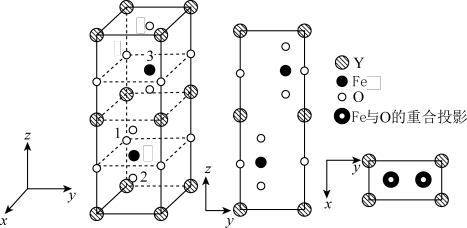
已知1号 原子分数坐标为
原子分数坐标为 ,2号
,2号 原子分数坐标为
原子分数坐标为 ,则3号
,则3号 原子的分数坐标为
原子的分数坐标为___________ ;若晶胞参数为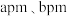 和
和 ,
, ,用
,用 表示阿伏伽德罗常数的值,则该晶体的密度为
表示阿伏伽德罗常数的值,则该晶体的密度为___________  (列出表达式)
(列出表达式)
 )在医药、催化及材料等领域中应用广泛。回答下列问题:
)在医药、催化及材料等领域中应用广泛。回答下列问题:(1)
 在元素周期表中的位置为
在元素周期表中的位置为 相同且电负性最小的元素是
相同且电负性最小的元素是(2)一种某铁的配合物结构如图所示。该物质中不含有的化学键类型是

A.离子键 B.配位键 C.非极性共价键 D.
 键 E.
键 E. 键
键在
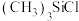 、
、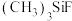 、
、 分子中,
分子中,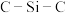 键角最大的是
键角最大的是(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

甘氨酸铜中铜原子的杂化类型为
 ”或“
”或“ ”);
”);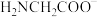 能与
能与 形成稳定的环状化合物,其原因是
形成稳定的环状化合物,其原因是(4)铁酸钇的正交相晶胞结构以及各原子的投影如图所示。

已知1号
 原子分数坐标为
原子分数坐标为 ,2号
,2号 原子分数坐标为
原子分数坐标为 ,则3号
,则3号 原子的分数坐标为
原子的分数坐标为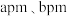 和
和 ,
, ,用
,用 表示阿伏伽德罗常数的值,则该晶体的密度为
表示阿伏伽德罗常数的值,则该晶体的密度为 (列出表达式)
(列出表达式)
您最近一年使用:0次
解题方法
4 . 下列关于B、 及其化合物的说法正确的是
及其化合物的说法正确的是
 及其化合物的说法正确的是
及其化合物的说法正确的是A. 能形成 能形成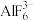 ,推测B也能形成 ,推测B也能形成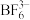 |
B.键能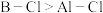 ,推测 ,推测 的熔点高于 的熔点高于 |
C. 是两性氢氧化物,推测 是两性氢氧化物,推测 也是两性氢氧化物 也是两性氢氧化物 |
| D.六方BN具有与石墨类似的层状结构,推测六方BN也可作润滑剂 |
您最近一年使用:0次
名校
解题方法
5 . 我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)基态Ge原子的核外电子排布式[Ar]_____ ;SiO2、GeO2具有类似的晶体结构,其中熔点较高的是_____ ,原因是______ 。
(2)Cs2CO3中阴离子的空间构型为_____ ,Cs2CO3中组成元素的电负性由大到小的顺序_____ (用元素符号作答)。
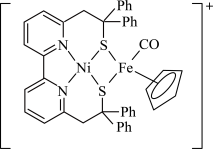
(3)和Ge同主族的碳可以形成含有大π键的茂环阴离子(C5H ),其大π键可表示为
),其大π键可表示为_____ ,该茂环阴离子(C5H )可以与Ni2+、Fe2+形成如图所示的配离子,茂环阴离子(C5H
)可以与Ni2+、Fe2+形成如图所示的配离子,茂环阴离子(C5H )作为配体以π电子参与配位,则配离子中铁周围的价电子数共有
)作为配体以π电子参与配位,则配离子中铁周围的价电子数共有_____ 个。
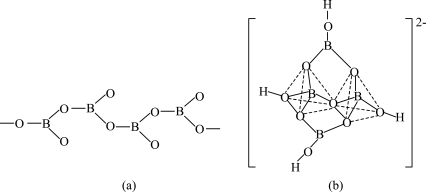
(4)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多硼酸根,其化学式为_____ ;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型为_____ 。
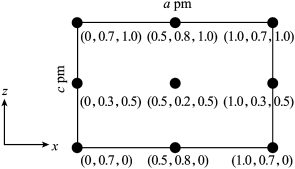
(5)CsSiB3O7属正交晶系(长方体形)。晶胞参数为apm、bpm、cpm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为_____ 。CsSiB3O7的摩尔质量为Mg•mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为______ g•cm-3(用代数式表示)。
(1)基态Ge原子的核外电子排布式[Ar]
(2)Cs2CO3中阴离子的空间构型为
(3)和Ge同主族的碳可以形成含有大π键的茂环阴离子(C5H
 ),其大π键可表示为
),其大π键可表示为 )可以与Ni2+、Fe2+形成如图所示的配离子,茂环阴离子(C5H
)可以与Ni2+、Fe2+形成如图所示的配离子,茂环阴离子(C5H )作为配体以π电子参与配位,则配离子中铁周围的价电子数共有
)作为配体以π电子参与配位,则配离子中铁周围的价电子数共有
(4)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多硼酸根,其化学式为

(5)CsSiB3O7属正交晶系(长方体形)。晶胞参数为apm、bpm、cpm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为

您最近一年使用:0次
名校
解题方法
6 . 配合物在工农业生产中有广泛应用。回答下列问题:
(1)铁的一种配合物的化学式为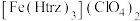 ,配体Htrz为三氮唑(
,配体Htrz为三氮唑(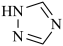 )
)
①基态 与
与 中未成对的电子数之比为
中未成对的电子数之比为___________ 。
②元素H、O、C、N电负性从小到大的顺序为___________ 。
③阴离子 的键角
的键角___________  的键角(填“等于”、“大于”或“小于”)。
的键角(填“等于”、“大于”或“小于”)。
④Htrz分子为平面结构,其中共有___________ 个σ键;
⑤三氮唑沸点为260℃,与其结构类似的环戊二烯沸点为42.5℃,三氮唑沸点明显偏高的原因是___________ 。
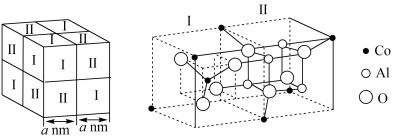
(2)钴蓝晶胞结构如下图所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,其化学式为___________ 。
(1)铁的一种配合物的化学式为
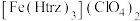 ,配体Htrz为三氮唑(
,配体Htrz为三氮唑( )
)①基态
 与
与 中未成对的电子数之比为
中未成对的电子数之比为②元素H、O、C、N电负性从小到大的顺序为
③阴离子
 的键角
的键角 的键角(填“等于”、“大于”或“小于”)。
的键角(填“等于”、“大于”或“小于”)。④Htrz分子为平面结构,其中共有
⑤三氮唑沸点为260℃,与其结构类似的环戊二烯沸点为42.5℃,三氮唑沸点明显偏高的原因是
(2)钴蓝晶胞结构如下图所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,其化学式为

您最近一年使用:0次
名校
7 . 2021年9月24日《科学》杂志发表了我国科学家的原创性重大突破,首次在实验室实现从 到淀粉的全合成。其合成路线如下:
到淀粉的全合成。其合成路线如下:
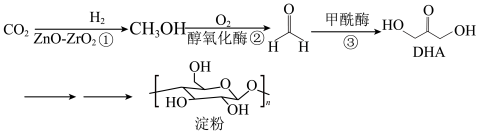
下列说法错误的是
 到淀粉的全合成。其合成路线如下:
到淀粉的全合成。其合成路线如下:
下列说法错误的是
| A.电负性:O>C>H>Zn |
| B.甲醇分子中H—C—O键角大于甲醛分子中H—C—O键角 |
| C.DHA分子间存在氢键 |
D.Zn溶于氨水形成配合物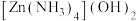 , , 的配位数为6 的配位数为6 |
您最近一年使用:0次
2023-03-17更新
|
218次组卷
|
2卷引用: 山东省淄博市沂源县第一中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
8 . 铝的卤化物AlX3(X=Cl、Br、I)气态时以Al2X6双聚形态存在,下列说法错误的是
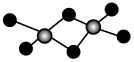

| 性质 | AlF3 | AlCl3 | AlBr3 | AlI3 |
| 熔点/℃ | 1290 | 192.4 | 97.8 | 189.4 |
| 沸点/℃ | 1272 | 180 | 256 | 382 |
| A.AlF3晶体类型与其他三种不同 |
| B.1molAl2Cl6中所含配位键数目为4NA |
| C.Al2X6中Al、X原子价电子层均满足8e-结构 |
| D.AlCl3熔点高于AlBr3原因是Cl的电负性大于Br,具有一定离子晶体特征 |
您最近一年使用:0次
2023-03-03更新
|
1375次组卷
|
9卷引用:山东省淄博市2022-2023学年高三第一次模拟考试化学试题
山东省淄博市2022-2023学年高三第一次模拟考试化学试题山东省单县第二中学2023届高三下学期第1次 阶段性质量检测化学试题(已下线)专题06 物质结构与性质黑龙江省双鸭山市第一中学2022-2023学年高二下学期4月月考(普通班)化学试题黑龙江省双鸭山市第一中学2022-2023学年高二下学期4月月考(实验班)化学试题辽宁省锦州市育明高级中学2022-2023学年高二下学期第一次阶段性考试化学试题辽宁省沈阳市东北育才学校(高中部)2022-2023学年高二下学期4月月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高二下学期期中考试化学试题广东省东莞市东莞外国语学校2023-2024学年高二上学期11月期中化学试题
名校
解题方法
9 . 离子液体是一种全部由离子组成的液体,它具有独特的性能,被广泛应用于化学研究的各个领域中。某离子液体由如图所示正离子和负离子构成。
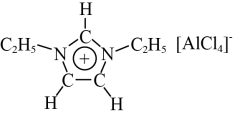
请回答下列问题:
(1)正离子中各元素的电负性由小到大的顺序为_____ (用元素符号表示);正离子中C原子的杂化方式为______ 。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为_____ 或_____ 。
(3)正离子中存在的作用力有_____ (填标号)。
a.极性共价键 b.非极性共价键 c.氢键 d.离子键
(4)基态Cl原子的价层电子的轨道表示式为_____ 。
(5)负离子的空间结构为_____ 形。
(6)分子中的大π键可用符号π 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(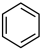 )中的大π键可表示为π
)中的大π键可表示为π 。则正离子中的大π键可表示为
。则正离子中的大π键可表示为_____ 。

请回答下列问题:
(1)正离子中各元素的电负性由小到大的顺序为
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为(3)正离子中存在的作用力有
a.极性共价键 b.非极性共价键 c.氢键 d.离子键
(4)基态Cl原子的价层电子的轨道表示式为
(5)负离子的空间结构为
(6)分子中的大π键可用符号π
 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯( )中的大π键可表示为π
)中的大π键可表示为π 。则正离子中的大π键可表示为
。则正离子中的大π键可表示为
您最近一年使用:0次
2023-02-28更新
|
300次组卷
|
2卷引用: 山东省淄博市沂源县第一中学2022-2023学年高二下学期3月月考化学试题
10 . 某阴离子结构式如图所示。W、X、Y、Z为原子序数依次增大的同一短周期元素,X原子的最外层电子数等于其电子层数的2倍。下列说法错误的是
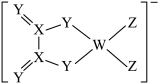

| A.电负性:Z>Y>X |
| B.简单氢化物沸点:Y<Z |
| C.最高价氧化物水化物的酸性:X>W |
| D.该阴离子中所有原子均满足最外层8电子稳定结构 |
您最近一年使用:0次
2022-12-16更新
|
185次组卷
|
3卷引用:山东省淄博市2022-2023学年高三上学期12月月考化学试题
山东省淄博市2022-2023学年高三上学期12月月考化学试题山东省淄博实验中学2022-2023学年高三上学期12月份摸底考试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)



