名校
解题方法
1 . 基于所学内容回答问题
(1)基态铜原子的价电子排布式为_________ ,其核外电子的空间运动状态有________ 种;As原子的价电子排布图为________________ 。
(2) 与
与 同周期,
同周期,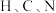 三种元素的电负性从小到大的顺序为
三种元素的电负性从小到大的顺序为________ ; 、
、 、
、 的第一电离能从大到小的顺序为
的第一电离能从大到小的顺序为________________ 。
(3) 的电子式
的电子式_________ , 的沸点高于
的沸点高于 的原因是
的原因是_________ 。
(4)已知 的熔点高于
的熔点高于 的熔点,其原因是
的熔点,其原因是__________________ 。
(5)铜的某种氧化物的晶胞结构如图所示,若该晶胞中 原子与
原子与 原子之间的最近距离为apm,设阿伏加德罗常数的值为
原子之间的最近距离为apm,设阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为_________  (填含
(填含 的表达式)。
的表达式)。
(1)基态铜原子的价电子排布式为
(2)
 与
与 同周期,
同周期,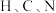 三种元素的电负性从小到大的顺序为
三种元素的电负性从小到大的顺序为 、
、 、
、 的第一电离能从大到小的顺序为
的第一电离能从大到小的顺序为(3)
 的电子式
的电子式 的沸点高于
的沸点高于 的原因是
的原因是(4)已知
 的熔点高于
的熔点高于 的熔点,其原因是
的熔点,其原因是(5)铜的某种氧化物的晶胞结构如图所示,若该晶胞中
 原子与
原子与 原子之间的最近距离为apm,设阿伏加德罗常数的值为
原子之间的最近距离为apm,设阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为 (填含
(填含 的表达式)。
的表达式)。 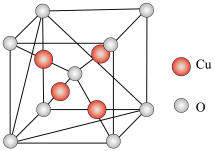
您最近一年使用:0次
2024-01-23更新
|
391次组卷
|
2卷引用:山东省聊城颐中外国语学校2023-2024学年高二下学期第一次质量检测化学试题
名校
2 . 二硫代磷酸酯的分子结构如图所示。下列说法错误的是
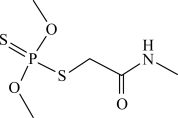
A.电负性: |
B.该分子中含有23个 键 键 |
C.该分子中碳原子的杂化方式为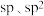 |
D.基态N原子价电子轨道表示式为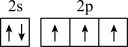 |
您最近一年使用:0次
2023-12-26更新
|
542次组卷
|
4卷引用:2023—2024学年高二上学期化学期末考试模拟试题(一)
解题方法
3 . 根据要求回答下列问题:
(1)在第二周期主族元素,第一电离能介于B和N之间的元素有___________ 种。
(2)嫦娥五号实现了我国首次地外天体采样返回,带回的月壤中包含了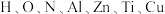 等多种元素,N的第一电离能大于O的,请说明理由:
等多种元素,N的第一电离能大于O的,请说明理由:_______ 。
(3)已知电离能: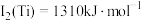 ,
,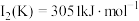 ,
,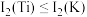 ,其原因为
,其原因为___________ 。
(4)橙红色晶体羰基钴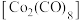 的熔点为
的熔点为 ,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为
,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为_________ (填元素符号)。配体 中
中 键与
键与 键数目之比是
键数目之比是___________ 。
(5)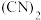 中键与键之间的夹角为
中键与键之间的夹角为 ,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为
,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为___________ ,1个分子中含有___________ 个 键。
键。
(6)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与 互为等电子体的分子有
互为等电子体的分子有___________ 、___________ 。
(1)在第二周期主族元素,第一电离能介于B和N之间的元素有
(2)嫦娥五号实现了我国首次地外天体采样返回,带回的月壤中包含了
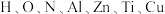 等多种元素,N的第一电离能大于O的,请说明理由:
等多种元素,N的第一电离能大于O的,请说明理由:(3)已知电离能:
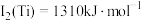 ,
,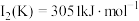 ,
,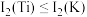 ,其原因为
,其原因为(4)橙红色晶体羰基钴
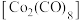 的熔点为
的熔点为 ,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为
,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为 中
中 键与
键与 键数目之比是
键数目之比是(5)
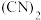 中键与键之间的夹角为
中键与键之间的夹角为 ,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为
,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 键。
键。(6)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与
 互为等电子体的分子有
互为等电子体的分子有
您最近一年使用:0次
2023-12-15更新
|
361次组卷
|
3卷引用:2023-2024学年高二上学期期末化学考试仿真卷(一)2019版选修一、选修二(部分)
4 . 有机物种类繁多,应用广泛。
(1)邻氨基吡啶(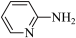 )的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为
)的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为_______ (填元素符号)。 能溶于水的原因是
能溶于水的原因是_______ 。
(2)鸟嘌呤和吡咯的结构如下图所示。
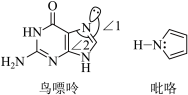
①鸟嘌呤中N原子的杂化方式为_______ ,夹角∠1_______ ∠2(填“>”或“<”)。
②分子中的大 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,吡咯中的大
键的电子数,吡咯中的大 键可表示为
键可表示为_______ 。
(3)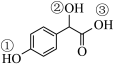 分子中3个-OH的电离能力由强到弱的顺序是
分子中3个-OH的电离能力由强到弱的顺序是_______ (用①、②、③表示)。
(4)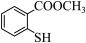 与
与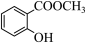 相比,前者的水溶性更
相比,前者的水溶性更_______ (填“大”或“小”)。—SH与—OH性质相似,写出与NaOH溶液反应的化学方程式_______ 。
(1)邻氨基吡啶(
 )的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为
)的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为 能溶于水的原因是
能溶于水的原因是(2)鸟嘌呤和吡咯的结构如下图所示。

①鸟嘌呤中N原子的杂化方式为
②分子中的大
 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,吡咯中的大
键的电子数,吡咯中的大 键可表示为
键可表示为(3)
 分子中3个-OH的电离能力由强到弱的顺序是
分子中3个-OH的电离能力由强到弱的顺序是(4)
 与
与 相比,前者的水溶性更
相比,前者的水溶性更
您最近一年使用:0次
2023-07-11更新
|
357次组卷
|
2卷引用:2023—2024学年高二上学期化学期末考试模拟试题(一)
名校
5 . 短周期主族元素W、X、Y、Q的原子序数依次增大。W、X原子的最外层电子数之和为6,且符合核反应: ;Y原子中s电子与p电子数目相同,Q的原子序数等于X原子序数的2倍。下列说法正确的是
;Y原子中s电子与p电子数目相同,Q的原子序数等于X原子序数的2倍。下列说法正确的是
 ;Y原子中s电子与p电子数目相同,Q的原子序数等于X原子序数的2倍。下列说法正确的是
;Y原子中s电子与p电子数目相同,Q的原子序数等于X原子序数的2倍。下列说法正确的是A.电负性: | B.X的最高价氧化物对应的水化物属于强酸 |
C.原子半径: | D.单质Q与X的最高价氧化物可以发生反应 |
您最近一年使用:0次
2023-05-12更新
|
678次组卷
|
4卷引用:山东省聊城市2023届高考一模化学试题
6 . 某团队研究了一种以酸作为催化剂的全新二硫类化合物的可逆聚合/解聚方法,如图所示。下列叙述正确的是
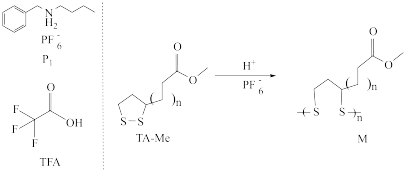

A.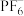 的空间结构为正四面体 的空间结构为正四面体 |
B. 合成M属于加聚反应 合成M属于加聚反应 |
C.TFA的酸性比 的酸性弱 的酸性弱 |
| D.二硫类化合物M具有耐碱腐蚀性能 |
您最近一年使用:0次
7 . 屠呦呦因在抗疟药青蒿素研究中的杰出贡献,成为我国首获科学类诺贝尔奖的人。青蒿素的结构简式如图所示,下列说法正确的是
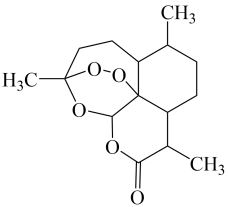

A.青蒿素的分子式为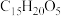 |
| B.组成元素的电负性由大到小顺序为:O>C>H |
| C.分子中所有碳原子的杂化方式相同 |
| D.分子中含有7个手性碳原子 |
您最近一年使用:0次
名校
8 . 现有原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子在基态时其最外层电子数是其内层电子数的2倍,Q原子在基态时其2p原子轨道上有2个未成对电子,W元素的原子中3d能级上有4个未成对电子。回答下列问题:
(1)化合物ZX3的沸点比化合物YX4的高,其主要原因是_______ 。
(2)元素W能形成多种配合物,其中W(CO)5在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)5晶体属于_______ (填晶体类型)晶体,该晶体中W的化合价为_______ 。
(3)下列说法正确的是_______ (填字母)。
A.分子晶体中,共价键的键能越大,该分子晶体的熔、沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为CaO中的离子键比KCl的强,所以KCl比CaO的熔点低
(4)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图所示,与一个阴离子距离最近且相等的所有阳离子为顶点构成的几何体为_______ 。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞边长为_______ cm。(用含ρ、NA的代数式表示)
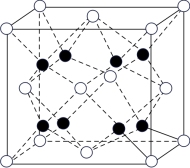
(1)化合物ZX3的沸点比化合物YX4的高,其主要原因是
(2)元素W能形成多种配合物,其中W(CO)5在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)5晶体属于
(3)下列说法正确的是
A.分子晶体中,共价键的键能越大,该分子晶体的熔、沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为CaO中的离子键比KCl的强,所以KCl比CaO的熔点低
(4)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图所示,与一个阴离子距离最近且相等的所有阳离子为顶点构成的几何体为

您最近一年使用:0次
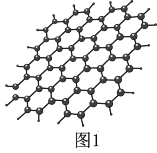
9 . 石墨烯、高温氯化钠、砷化镉等超导材料应用广泛。回答下列问题:
(1)石墨烯结构如图1所示,则碳原子的杂化方式为_______ ,12 g石墨烯中含有六元环个数与σ键个数之比为_______ 。
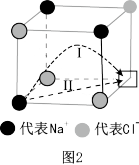
(2)温度升高时,NaCl晶体出现缺陷,如图2方格处填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径_______ (填图中序号)迁移到空位处。
(3)石墨烯限域单原子铁催化剂使CH4在室温条件下被H2O2直接氧化为HCHO、HCOOH,比较HCHO、HCOOH的沸点高低并说明理由_______ 。
(4)镉(Cd)与Zn同族且相邻,则基态Cd原子的价电子排布式为_______ ;与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3强于PH3,原因是_______ 。
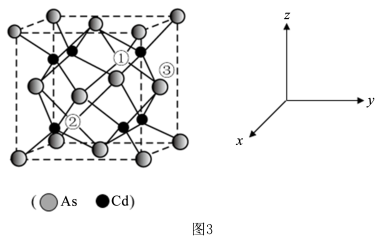
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构为正方体如图3, 占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为_______ 。晶胞的密度为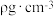 ,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为_______ pm(列计算式即可)。
(1)石墨烯结构如图1所示,则碳原子的杂化方式为

(2)温度升高时,NaCl晶体出现缺陷,如图2方格处填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
(3)石墨烯限域单原子铁催化剂使CH4在室温条件下被H2O2直接氧化为HCHO、HCOOH,比较HCHO、HCOOH的沸点高低并说明理由
(4)镉(Cd)与Zn同族且相邻,则基态Cd原子的价电子排布式为
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构为正方体如图3,
 占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为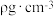 ,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
您最近一年使用:0次
2022-03-29更新
|
700次组卷
|
4卷引用:山东省聊城市2021-2022学年下学期高三一模化学试题
山东省聊城市2021-2022学年下学期高三一模化学试题(已下线)必刷卷02-2022年高考化学考前信息必刷卷(山东专用)(已下线)必刷卷05-2022年高考化学考前信息必刷卷(河北专用)河北省石家庄市第二中学2022届高三2.5模化学试题
名校
10 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y同族但不相邻,基态Z原子价电子排布nsn-1npn+1。下列说法正确的是
| A.简单离子半径:W>Z>Y>X | B.简单阴离子还原性:Z>W |
| C.电负性:Z>W | D.Z与W的简单气态氢化物沸点Z>W |
您最近一年使用:0次
2022-03-03更新
|
406次组卷
|
3卷引用:山东省聊城市第一中学2021-2022学年高三上学期期末考试化学试题
山东省聊城市第一中学2021-2022学年高三上学期期末考试化学试题黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题



