1 . [2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________ ,有__________ 个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________ 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________ 。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________ 。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________ ,微粒之间存在的作用力是_______________ 。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______________ 。_____ g·cm−3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为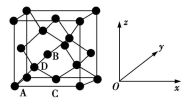
您最近半年使用:0次
2016-12-09更新
|
6976次组卷
|
32卷引用:2016年全国普通高等学校招生统一考试化学(新课标1卷精编版)
2016年全国普通高等学校招生统一考试化学(新课标1卷精编版)2016年全国普通高等学校招生统一考试化学(全国1卷参考版)2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷河南省郑州市八校2016-2017学年高二下学期期中联考化学试题2017届山东省潍坊市实验中学高三下学期第四次单元过关测试理科综合化学试卷云南民族大学附属中学2017-2018学年高二下学期第一次月考化学试题(已下线)《考前20天终极攻略》5月30日 物质结构与性质(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密云南省澄江县第一中学2019届高三9月月考理科综合化学试题云南省玉溪市峨山一中2019届高三9月上学期月考化学试题云南省玉溪市新平县第一中学2019届高三第一次月考理综化学试题云南省新平一中2019届高三上学期12月考试化学试题广东省深圳外国语学校2019届高三第一次月考理综化学试题鲁科版高中化学选修3模块综合测评卷新疆乌鲁木齐县柴窝堡林场中学2019届高三四月调研考试理综化学试题百所名校联考-物质结构与性质云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题贵州省三都水族自治县高级中学2019-2020学年高三上学期期末考试理综化学试题贵州省剑河县第二中学2019-2020学年高三上学期期末考试化学试题宁夏石嘴山市第三中学2019-2020学年高二下学期期中考试化学试题湖南省衡阳市2020年高中毕业班教学质量监测卷理科综合化学宁夏海原县第一中学2019-2020学年高二下学期第一次月考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题广东省深圳市罗湖区2022届高三上学期第一次质量检测化学试题贵州省威宁县第八中学2021-2022学年高三上学期第一次月考化学试题陕西省武功县2021-2022学年高三上学期第二次质量检测理科综合化学试题 陕西省汉中市2022届高三下学期第五次校级联考理科综合化学试题云南省曲靖市宣威市第七中学2021-2022学年高三下学期3月考试化学试题湖南省岳阳市汨罗市第二中学2022届高三下学期期中考试化学试题山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题山东省青岛一中2023-2024学年高二下学期第二次月考化学试卷
2 . 科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______ 。
(2)下列关于CH4和CO2的说法正确的是______ (填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________ ,Ni该元素位于元素周期表的第___ 族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____ molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。


①“可燃冰”中分子间存在的2种作用力是______ 。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________ 。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为
(2)下列关于CH4和CO2的说法正确的是
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。


①“可燃冰”中分子间存在的2种作用力是
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
您最近半年使用:0次
2016-12-09更新
|
1714次组卷
|
3卷引用:2015年全国普通高等学校招生统一考试化学(福建卷)
真题
3 . C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式_______ 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为_______ 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为_______ ,微粒间存在的作用力是_______ 。
(3)氧化物MO的电子总数与SiC的相等,则M为_______ (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是_______ 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成 键和
键和 键,SiO2中Si与O原子间不形成上述
键,SiO2中Si与O原子间不形成上述 键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述
键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述 键
键_______ 。
(1)写出Si的基态原子核外电子排布式
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(3)氧化物MO的电子总数与SiC的相等,则M为
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成
 键和
键和 键,SiO2中Si与O原子间不形成上述
键,SiO2中Si与O原子间不形成上述 键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述
键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述 键
键
您最近半年使用:0次
2016-12-09更新
|
942次组卷
|
2卷引用:2009年普通高等学校招生统一考试理综试题化学部分(山东卷)



