1 . 下列物质的结构或性质及其解释均正确的是
| 选项 | 物质的结构或性质 | 解释 |
| A | 极性: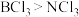 | B元素和Cl元素的电负性差值大于N元素和Cl元素的电负性差值 |
| B | 沸点:对羟基苯甲醛>邻羟基苯甲醛 | 对羟基苯甲醇分子间范德华力更强 |
| C |  在水中的溶解度比在 在水中的溶解度比在 中的溶解度更大 中的溶解度更大 |  是弱极性分子 是弱极性分子 |
| D | 电子云半径3s>1s | 3s电子能量高,在离核更远的区域出现的概率大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 下列有关物质结构与性质的比较正确的是
A.分子的极性: | B.酸性: |
C.键角: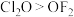 | D.基态原子未成对电子数:Mn>Cr |
您最近一年使用:0次
2023-12-16更新
|
606次组卷
|
5卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期末质量检化学试题
解题方法
3 . 食用碱是人们生活中常用的食品疏松剂和肉类嫩化剂,其成分为纯碱 和小苏打
和小苏打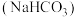 。下列说法正确的是
。下列说法正确的是
 和小苏打
和小苏打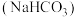 。下列说法正确的是
。下列说法正确的是A.离子半径: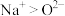 | B.电负性: |
C.非金属性: | D.第一电离能: |
您最近一年使用:0次
2023-12-01更新
|
567次组卷
|
6卷引用:陕西省西安市2023-2024学年高二上学期期末考试化学试题
陕西省西安市2023-2024学年高二上学期期末考试化学试题(已下线)猜想01 原子结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)河北省邯郸市六校联考2023-2024学年高二上学期11月月考化学试题(已下线)热点02 原子结构与元素的性质河北省邢台市四校联盟2023-2024学年高二上学期11月月考化学试题辽宁省铁岭市调兵山市第二高级中学2023-2024学年高二下学期开学考试化学试题
解题方法
4 . 非金属氮化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态N原子核外电子的运动状态有___________ 种,其核外电子占据能量最高的能级电子云轮廓图形状为___________ 。
(2)氟化硝酰(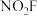 )可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为
)可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为___________ ;第一电离能由大到小顺序为_________ 。
(3)气态 的分子结构为
的分子结构为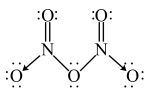 ,而固态
,而固态 则由
则由 与
与 构成。
构成。 的空间构型为
的空间构型为_________ , 中N的杂化方式为
中N的杂化方式为___________ 。
(4)一种新型的氮碳化合物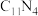 的晶体属于四方晶系,其沿着y轴的投影如图1所示,晶胞参数及侧视图如图2所示。
的晶体属于四方晶系,其沿着y轴的投影如图1所示,晶胞参数及侧视图如图2所示。______ 。
(5)已知某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___________ ,若该晶体的密度是 ,则晶胞中两个最近的Fe的核间距离为
,则晶胞中两个最近的Fe的核间距离为___________ cm(用含 、
、 的代数式表示)。
的代数式表示)。
(1)基态N原子核外电子的运动状态有
(2)氟化硝酰(
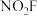 )可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为
)可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为(3)气态
 的分子结构为
的分子结构为 ,而固态
,而固态 则由
则由 与
与 构成。
构成。 的空间构型为
的空间构型为 中N的杂化方式为
中N的杂化方式为(4)一种新型的氮碳化合物
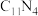 的晶体属于四方晶系,其沿着y轴的投影如图1所示,晶胞参数及侧视图如图2所示。
的晶体属于四方晶系,其沿着y轴的投影如图1所示,晶胞参数及侧视图如图2所示。
(5)已知某氮化铁的晶胞结构如图所示,则氮化铁的化学式为
 ,则晶胞中两个最近的Fe的核间距离为
,则晶胞中两个最近的Fe的核间距离为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
5 . A、B、C、D是前三周期的主族元素。A、B、C同周期,C、D同主族且原子半径C>D,A的原子结构示意图为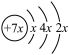 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子。回答下列问题:
(1)写出下列元素的符号:B___________ 。
(2)用元素符号表示D所在周期第一电离能最大的元素是___________ ,电负性最大的元素是___________ 。
(3)基态D原子的价电子排布图___________ ,元素D的原子最外层共有___________ 种不同运动状态的电子。基态原D子电子占据最高能级的电子云轮廓图为___________ 形。
(4)A、B、C三者原子半径由大到小的顺序为___________ (用元素符号回答)。
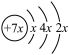 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子。回答下列问题:(1)写出下列元素的符号:B
(2)用元素符号表示D所在周期第一电离能最大的元素是
(3)基态D原子的价电子排布图
(4)A、B、C三者原子半径由大到小的顺序为
您最近一年使用:0次
名校
6 . X、Y、Z、W、Q是原子序数依次增大的短周期主族元素。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法正确的是
A.第一电离能: | B.简单氢化物沸点: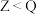 |
C.最高价含氧酸的酸性: | D.电负性: |
您最近一年使用:0次
2023-07-17更新
|
97次组卷
|
3卷引用:陕西省宝鸡市金台区2023-2024学年高二上学期期末检测化学试题
名校
7 . 有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素。X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子层排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第ⅠA族元素。回答下列问题:
(1)写出第三周期基态原子未成对电子数与G相同且电负性最大的元素是___________ (填元素名称)。GQ受热分解生成G2Q和Q2,请从G的原子结构来说明GQ受热易分解的原因:_______ 。
(2)M元素的第一电离能在同周期主族元素中从大到小排第三位的原因是_____________ 。
(3)X与Q形成的化合物中沸点较高的物质的化学式为___________ 。
(4)Z、M、E所形成的简单离子的半径由大到小顺序为___________ (用离子符号表示)。
(5)X、Y、Z、Q的电负性由大到小的顺序为___________ (用元素符号表示)。
(1)写出第三周期基态原子未成对电子数与G相同且电负性最大的元素是
(2)M元素的第一电离能在同周期主族元素中从大到小排第三位的原因是
(3)X与Q形成的化合物中沸点较高的物质的化学式为
(4)Z、M、E所形成的简单离子的半径由大到小顺序为
(5)X、Y、Z、Q的电负性由大到小的顺序为
您最近一年使用:0次
8 . A、B、C、D、E、F、G是元素周期表前四周期常见的元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)A在元素周期表中的位置为___________ ,画出基态B原子的轨道表示式___________ 。
(2)F元素基态原子的最高能级具有的原子轨道数为___________ ,该原子轨道呈___________ 形。
(3)已知元素A、B形成的 链状分子中所有的原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为
链状分子中所有的原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为___________ 。
(4)C元素可形成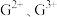 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(5)短周期元素M与元素E在周期表中的位置呈现对角线关系,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ (填“离子”或“共价”)化合物。推测M的最高价氧化物对应的水化物___________ (填“能”或“不能”)与D的最高价氧化物对应水化物发生反应。
| A | 原子核外有6个电子 |
| B | 原子序数比A大1 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子价层电子排布式为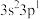 |
| F | 基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(2)F元素基态原子的最高能级具有的原子轨道数为
(3)已知元素A、B形成的
 链状分子中所有的原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为
链状分子中所有的原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为(4)C元素可形成
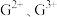 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(5)短周期元素M与元素E在周期表中的位置呈现对角线关系,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
您最近一年使用:0次
名校
解题方法
9 . 臭氧(O3)在 的催化下能将烟气中的
的催化下能将烟气中的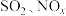 ,分别氧化为
,分别氧化为 和
和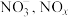 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。
(1) 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为___________ ; 的空间构型为
的空间构型为___________ 。
(2)写出一种与 分子互为等电子体的分子:
分子互为等电子体的分子:___________ (填化学式)。
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为___________ 。

(4) 与
与 反应生成
反应生成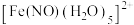 以N原子与
以N原子与 形成配位键,画出配离子
形成配位键,画出配离子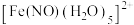 的结构式:
的结构式:___________ (用“→”标出相应的配位键)。
(5)C、N、O元素的性质由大到小的顺序:电负性___________ ;第一电离能___________ 。
 的催化下能将烟气中的
的催化下能将烟气中的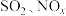 ,分别氧化为
,分别氧化为 和
和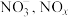 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。(1)
 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为 的空间构型为
的空间构型为(2)写出一种与
 分子互为等电子体的分子:
分子互为等电子体的分子:(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为

(4)
 与
与 反应生成
反应生成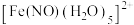 以N原子与
以N原子与 形成配位键,画出配离子
形成配位键,画出配离子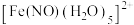 的结构式:
的结构式:(5)C、N、O元素的性质由大到小的顺序:电负性
您最近一年使用:0次
2023-06-29更新
|
30次组卷
|
2卷引用:陕西省西安市阎良区2022-2023学年高二下学期期末检测化学试题
名校
解题方法
10 . 下列说法不正确的是
| A.电负性:N> P>Li |
B.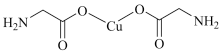 中σ键和 中σ键和 键比例为7:1 键比例为7:1 |
C.N2与 互为等电子体, 互为等电子体, 中含有的 中含有的 键数目为 键数目为 |
D.C 中的所有原子均共面 中的所有原子均共面 |
您最近一年使用:0次
2023-04-08更新
|
252次组卷
|
3卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期末质量检化学试题



