名校
1 . 现有A、B、C、D四种元素,A是第五周期第ⅣA族元素,B是第三周期元素,B、C、D的价电子数分别为2、2、7。四种元素原子序数从小到大的顺序是B、C、D、A。已知C和D的次外层电子数均为18个。
(1)写出A、B、C、D的元素符号:A________ 、B________ 、C________ 、D________ 。
(2)C位于元素周期表的________ 区,C2+的电子排布式______________________________ 。
(3)最高价氧化物对应水化物中碱性最强的化合物是________ (写化学式,下同);最高价氧化物对应水化物中酸性最强的化合物是________ 。
(4)元素的第一电离能最小的是________ ,元素的电负性最大的是________ 。
(1)写出A、B、C、D的元素符号:A
(2)C位于元素周期表的
(3)最高价氧化物对应水化物中碱性最强的化合物是
(4)元素的第一电离能最小的是
您最近一年使用:0次
2019-07-22更新
|
316次组卷
|
10卷引用:云南省丘北二中2018-2019学年高二下学期期末考试化学试题
云南省丘北二中2018-2019学年高二下学期期末考试化学试题云南省富宁县三中2019-2020学年高二上学期期末考试化学试题云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题云南省楚雄州南华县第一中学2019-2020学年高二9月考试化学试题(已下线)2019年11月23日 周末培优-学易试题君之每日一题君2020年高考化学一轮复习云南省玉溪市江川二中2019-2020学年高二上学期期中考试化学试题云南省禄丰县民族中学2019-2020学年高二12月月考化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题云南省施甸县第三中学2019-2020学年高二12月月考化学试题安徽省合肥市第一中学2022-2023学年高二下学期第一次质量检测化学试题
9-10高二下·黑龙江鹤岗·期末
解题方法
2 . 下列说法正确的有____________ 。
(1)每一周期元素都是从碱金属开始,以稀有气体结束
(2)f区都是副族元素,s区和p区的都是主族元素
(3)铝的第一电离能大于K的第一电离能
(4)B电负性和Si相近
(5)Ge的电负性为1.8,则其是典型的非金属
(6)半径:K+>Cl—
(7)酸性 HClO>H2SO4,碱性:NaOH > Mg(OH)2
(8)元素的最高正化合价=其最外层电子数=族序数
(1)每一周期元素都是从碱金属开始,以稀有气体结束
(2)f区都是副族元素,s区和p区的都是主族元素
(3)铝的第一电离能大于K的第一电离能
(4)B电负性和Si相近
(5)Ge的电负性为1.8,则其是典型的非金属
(6)半径:K+>Cl—
(7)酸性 HClO>H2SO4,碱性:NaOH > Mg(OH)2
(8)元素的最高正化合价=其最外层电子数=族序数
您最近一年使用:0次
3 . 氧族元素及其化合物在生产、生活中发挥着重要的作用。回答如下问题:
(1)氧元素在元素周期表中的位置__________ 。基态氧原子的价层电子轨道表示式为__________ ,电子占据最高能级的电子云轮廓图为__________ 形。
(2)硫为__________ 区元素,P、S、Cl的电负性由大到小的顺序为__________ 。
(3) 、
、 、
、 沸点由大到小的顺序为
沸点由大到小的顺序为__________ 。
(4)硫酸的结构式如图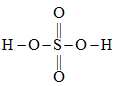 ,比较酸性:
,比较酸性: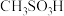
__________ 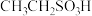 (填“大于”“小于”或“等于”),并说明原因:
(填“大于”“小于”或“等于”),并说明原因:__________ 。
(1)氧元素在元素周期表中的位置
(2)硫为
(3)
 、
、 、
、 沸点由大到小的顺序为
沸点由大到小的顺序为(4)硫酸的结构式如图
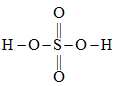 ,比较酸性:
,比较酸性: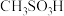
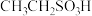 (填“大于”“小于”或“等于”),并说明原因:
(填“大于”“小于”或“等于”),并说明原因:
您最近一年使用:0次
名校
4 . 下列对分子及其性质的解释中,不正确的是
| A.CF3COOH的酸性大于CCl3COOH |
| B.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
| C.许多过渡金属离子对多种配体具有很强的结合力,因而只有过渡金属才能形成配合物 |
| D.已知酸性:HClO2>HClO,是因为HClO2分子中有1个非羟基氧原子而HClO为0 |
您最近一年使用:0次
5 . 电能是一种无污染、可再生的二级能源。储电材料种类繁多。如图是两种储电材料,请阅读试题、观察图片,回答问题。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。

(1)图1中化学键σ键与π键之比为_____ ;图2中碳原子的杂化方式为_____ 。
(2)图3中,储电材料的分子式可以表示为_____ 。
(3)碳元素与氮元素的电负性大小关系为____ 。氮元素与氧元素的第一电离能大小关系为_______ 。
(4)碳的最高价含氧酸根的空间构型是_____ ;硝酸的酸性强于亚硝酸的原因是_____ 。
Ⅱ.传统锂电池的主要成分是 LiCoO2其晶胞结构如图所示;因结构中存在笼状空隙, 可以与Ni 和Mn 发生位置替换, 形成储电性能更加优良的化合物LiNi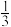 Mn
Mn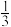 Co
Co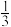 O2。
O2。

(5)基态 Co 原子的价电子排布式为_______ ; 化合物 LiCoO2中 O元素在晶胞中的位置,除了位于六棱柱的顶点外,其他具体位置是_____ 。
(6)已知化合物中各原子半径依次为:Li=a,Ni=b,Mn=c,Co=d,O= e,晶胞的棱长为 m,底边边长为n ,该晶体的空间利用率的计算表达式为________ (用含有 a、b、c、d、e、m、n 的式子表示 )。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。

(1)图1中化学键σ键与π键之比为
(2)图3中,储电材料的分子式可以表示为
(3)碳元素与氮元素的电负性大小关系为
(4)碳的最高价含氧酸根的空间构型是
Ⅱ.传统锂电池的主要成分是 LiCoO2其晶胞结构如图所示;因结构中存在笼状空隙, 可以与Ni 和Mn 发生位置替换, 形成储电性能更加优良的化合物LiNi
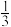 Mn
Mn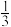 Co
Co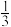 O2。
O2。
(5)基态 Co 原子的价电子排布式为
(6)已知化合物中各原子半径依次为:Li=a,Ni=b,Mn=c,Co=d,O= e,晶胞的棱长为 m,底边边长为n ,该晶体的空间利用率的计算表达式为
您最近一年使用:0次
名校
解题方法
6 . 利用铜萃取剂M,通过如下反应实现铜离子的富集:
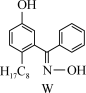
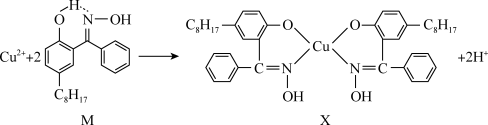
(1)关于M所含元素的说法正确的是______________ 。
A.电负性由大到小顺序:O>N>C>H
B.第一电离能由大到小的顺序:O>N>C
C.氮原子以sp2杂化轨道与氧原子形成σ键
D.从物质分类角度M属于芳香烃,M中所有的碳原子不可能共面
E.组成M元素的氢化物稳定性:CH4<H2O<NH3
(2)上述反应中断裂和生成的化学键有_______ (填序号)。
A.氢键 B.配位键 C.金属键 D.范德华力 E.共价键 F.离子键
(3)M与W(分子结构如上图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_______________ 。
(4)基态Cu2+的外围电子排布图为________________ ,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是_____________________________________________________________ 。
(5)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表Y原子)。
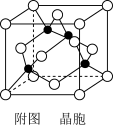
①该晶体的化学式为_______________ 。(用元素符号表示)
②已知铜和Y原子的电负性分别为1.9和3.0,则铜与Y原子形成的化合物属于____________ (填“离子”或“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子与Y原子之间的最短距离为_______________ pm(只写计算式)。


(1)关于M所含元素的说法正确的是
A.电负性由大到小顺序:O>N>C>H
B.第一电离能由大到小的顺序:O>N>C
C.氮原子以sp2杂化轨道与氧原子形成σ键
D.从物质分类角度M属于芳香烃,M中所有的碳原子不可能共面
E.组成M元素的氢化物稳定性:CH4<H2O<NH3
(2)上述反应中断裂和生成的化学键有
A.氢键 B.配位键 C.金属键 D.范德华力 E.共价键 F.离子键
(3)M与W(分子结构如上图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是
(4)基态Cu2+的外围电子排布图为
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表Y原子)。

①该晶体的化学式为
②已知铜和Y原子的电负性分别为1.9和3.0,则铜与Y原子形成的化合物属于
③已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子与Y原子之间的最短距离为
您最近一年使用:0次
名校
解题方法
7 . 已知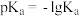 ,如图下表是几种不同有机酸的
,如图下表是几种不同有机酸的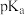 大小,由此产生的推测正确的是
大小,由此产生的推测正确的是
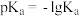 ,如图下表是几种不同有机酸的
,如图下表是几种不同有机酸的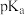 大小,由此产生的推测正确的是
大小,由此产生的推测正确的是| 有机酸 |  |  | 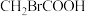 | 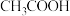 |
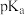 | 2.66 | 2.86 | 2.9 | 4.74 |
A.对键合电子吸引力: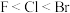 | B.酸性: |
C. | D.碱性: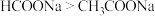 |
您最近一年使用:0次
2024-02-19更新
|
187次组卷
|
3卷引用:河北正定中学本部2023-2024学年高二上学期期末考试化学试题



