名校
解题方法
1 . 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+原子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素在周期表中的位置为_______ ,属于_______ 区。
(2)B、C、D三种元素的第一电离能最大的是_______ (填元素符号),第一电离能最大的原因是_______ 。
(3)D元素与氟元素相比,电负性:D_______ F(填“>”“=”或“<”),下列表述中能证明这一事实的是_______ (填字母)。
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物CA5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为_______ 。
(1)E元素在周期表中的位置为
(2)B、C、D三种元素的第一电离能最大的是
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物CA5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为
您最近一年使用:0次
2022-08-28更新
|
312次组卷
|
4卷引用:四川省眉山北外附属东坡外国语学校2023-2024学年高二下学期开学化学试题
名校
2 . 下列与分子性质有关的说法正确的是
| A.氟代丙二酸(HOOC—CF2—COOH)的酸性强于丙二酸(HOOC—CH2—COOH)是因为—CF2—的极性大于—CH2—的极性,导致氟代丙二酸羧基中—OH的极性更大更易电离出H+ |
B.邻硝基苯酚(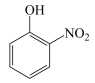 )的沸点高于对硝基苯酚( )的沸点高于对硝基苯酚(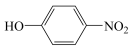 )是因为后者形成了分子间氢键 )是因为后者形成了分子间氢键 |
| C.C的电负性强于Si,所以CH4的熔沸点高于SiH4 |
| D.I2受热易升华,是因为分子内共价键键能较小所致 |
您最近一年使用:0次
名校
解题方法
3 . X、Y、Z、R、Q是元素周期表中原子序数依次增大的前四周期元素,X是宇宙中含量最多的元素;Y与Z同周期,Y基态原子有3个未成对电子,Z元素原子的价层电子排布为 ;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中
;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中不正确 的是
 ;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中
;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中A.简单气态氢化物的热稳定性: | B.第一电离能: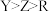 |
| C.Q在周期表的ds区 | D.电负性: |
您最近一年使用:0次
2023-12-23更新
|
539次组卷
|
3卷引用:江西省宜春市丰城中学东校区(九中)2023-2024学年高二下学期开学考试化学试卷
名校
解题方法
4 . 周期表中ⅢA族单质及其化合物应用广泛。BF3极易水解生成HBF4(HBF4在水中完全电离为H+和BF )和硼酸(H3BO3),硼酸是一元弱酸,能溶于水。硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。GaN的结构与晶体硅类似,是第三代半导体研究的热点。
)和硼酸(H3BO3),硼酸是一元弱酸,能溶于水。硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。GaN的结构与晶体硅类似,是第三代半导体研究的热点。
(1)Ga原子基态外围电子排布式为_____ 。
(2)在第二周期里,第一电离能介于B、N之间的元素有_____ 种;B(OCH3)3分子间_____ (填“能”或“不能”)能形成氢键,GaN属于_____ 晶体。
(3)硼酸是一元弱酸,它的水溶液之所以呈弱酸性并非本身能电离出H+,而是它结合了一个OH-,这种电离方式可表示为B(OH)3+H2O H++
H++_____ 。
(4)硼酸是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。下列有关说法正确的是_____(填字母)。

(5)Al2O3的熔点(2054℃)很高,工业冶炼铝时要加入冰晶石(化学式为Na3AlF6)来降低生产成本,如图所示为冰晶石的晶胞。图中“ ”位于大立方体顶点和面心,“
”位于大立方体顶点和面心,“ ”位于大立方体的12条棱的中点和8个小立方体的体心。则大立方体的体心处△代表的微粒是
”位于大立方体的12条棱的中点和8个小立方体的体心。则大立方体的体心处△代表的微粒是______ (填“Na+”或“AlF63-”),与Na+距离相等且最近的Na+有_____ 个。

 )和硼酸(H3BO3),硼酸是一元弱酸,能溶于水。硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。GaN的结构与晶体硅类似,是第三代半导体研究的热点。
)和硼酸(H3BO3),硼酸是一元弱酸,能溶于水。硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。GaN的结构与晶体硅类似,是第三代半导体研究的热点。(1)Ga原子基态外围电子排布式为
(2)在第二周期里,第一电离能介于B、N之间的元素有
(3)硼酸是一元弱酸,它的水溶液之所以呈弱酸性并非本身能电离出H+,而是它结合了一个OH-,这种电离方式可表示为B(OH)3+H2O
 H++
H++(4)硼酸是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。下列有关说法正确的是_____(填字母)。

| A.硼酸晶体的熔点比NaBF4低 |
| B.H3BO3分子的热稳定性与氢键有关 |
| C.含1molH3BO3的晶体中有3mol氢键 |
| D.BF3分子中每个原子最外层均满足8电子结构 |
(5)Al2O3的熔点(2054℃)很高,工业冶炼铝时要加入冰晶石(化学式为Na3AlF6)来降低生产成本,如图所示为冰晶石的晶胞。图中“
 ”位于大立方体顶点和面心,“
”位于大立方体顶点和面心,“ ”位于大立方体的12条棱的中点和8个小立方体的体心。则大立方体的体心处△代表的微粒是
”位于大立方体的12条棱的中点和8个小立方体的体心。则大立方体的体心处△代表的微粒是
您最近一年使用:0次
2023-12-11更新
|
198次组卷
|
2卷引用:重庆市万州二中2023-2024学年高二下学期开学考试 化学
名校
解题方法
5 . 某种合成医药、农药的中间体W结构如图所示,其中X、Y、Z、M、R均为短周期元素,原子序数依次增大。下列说法错误的是
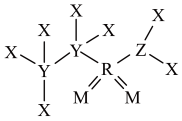
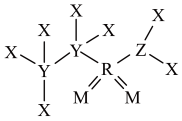
| A.简单氢化物沸点:Y<Z | B.电负性:M>Z>Y |
| C.第一电离能:Y<Z<M | D.W分子中R的杂化方式为sp3 |
您最近一年使用:0次
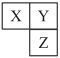
6 . 已知 、
、 、
、 三种短周期元素在周期表中的相对位置如图所示,
三种短周期元素在周期表中的相对位置如图所示, 基态原子
基态原子 能级和
能级和 能级的电子数相等,下列说法错误的是
能级的电子数相等,下列说法错误的是
 、
、 、
、 三种短周期元素在周期表中的相对位置如图所示,
三种短周期元素在周期表中的相对位置如图所示, 基态原子
基态原子 能级和
能级和 能级的电子数相等,下列说法错误的是
能级的电子数相等,下列说法错误的是
A.在三种元素形成的气态氢化物中, 的气态氢化物最稳定 的气态氢化物最稳定 |
B.简单氢化物的沸点: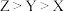 |
C.三种元素原子半径的大小顺序: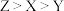 |
D. 、 、 元素原子的电负性: 元素原子的电负性: , , 元素原子的第一电离能: 元素原子的第一电离能: |
您最近一年使用:0次
名校
7 . 下列说法不正确的是
A.HClO分子空间构型为直线形,沸点: > >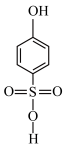 |
| B.NCl3和PCl3分子中,电负性:N>P,键角:∠Cl-N-Cl>∠Cl-P-Cl |
| C.Mg原子的两种激发态[Ne]3s13p1和[Ne]3p2中,前者第二电离能更大 |
| D.O3是空间结构为V形的弱极性分子,水中的溶解度大于O2,基态S原子核外电子的空间运动状态有9种 |
您最近一年使用:0次
名校
8 . 下列说法中正确的是
| A.电子云图中的小黑点密表示该核外空间的电子多 |
B.电子排布式 违反了洪特规则 违反了洪特规则 |
| C.原子序数为7、8、9的三种元素,其第一电离能和电负性均依次增大 |
| D.电子仅由激发态跃迁到基态时才会产生原子光谱 |
您最近一年使用:0次
2024-04-04更新
|
199次组卷
|
2卷引用:黑龙江省大庆市大庆中学2023-2024学年高二下学期开学化学试题
名校
解题方法
9 . 某种离子液体的结构如图所示,其中X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,Z与Q同主族。下列说法错误的是


| A.简单离子半径:Q>Z>W | B.简单氢化物键角:Y>Z>Q |
| C.最高价氧化物对应水化物的酸性:Z<Q | D.元素的电负性:Z>Y>X |
您最近一年使用:0次
名校
解题方法
10 . 化学,让生活更美好。回答下列问题:
(1)乳酸亚铁 是一种常用的补铁剂。
是一种常用的补铁剂。
①基态 核外电子的空间运动状态有
核外电子的空间运动状态有__________ 种。
②乳酸分子中 键与
键与 键的数目比为
键的数目比为__________ 。
③乳酸亚铁中各元素的电负性由大到小的顺序为__________ 。
(2)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①该新药分子中有__________ 种不同化学环境的C原子。
②研究发现,适量硒酸钠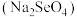 可减轻重金属铊引起的中毒。比较键角大小:
可减轻重金属铊引起的中毒。比较键角大小: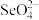
__________  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是__________ 。
(3) 广泛应用于太阳能电池领域。以
广泛应用于太阳能电池领域。以 、
、 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图1所示,
。抗坏血酸的分子结构如图1所示, 晶胞如图2所示。
晶胞如图2所示。

①抗坏血酸的分子式是__________ , 的价层电子轨道表示式为
的价层电子轨道表示式为__________ 。
②下列说法中不正确 的是__________ 。
A.抗坏血酸分子中碳原子的轨道杂化类型为
B.抗坏血酸难溶于水,易溶于乙醇
C.抗坏血酸与足量氢气完全催化还原后的分子中有5个手性碳原子
D. 在水溶液中以
在水溶液中以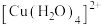 形式存在,
形式存在,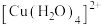 的配位原子为
的配位原子为
③ 晶胞为立方体,边长为
晶胞为立方体,边长为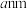 ,设
,设 为阿伏加德罗常数的值,则晶胞的密度
为阿伏加德罗常数的值,则晶胞的密度
__________  。
。
(1)乳酸亚铁
 是一种常用的补铁剂。
是一种常用的补铁剂。①基态
 核外电子的空间运动状态有
核外电子的空间运动状态有②乳酸分子中
 键与
键与 键的数目比为
键的数目比为③乳酸亚铁中各元素的电负性由大到小的顺序为
(2)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①该新药分子中有
②研究发现,适量硒酸钠
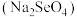 可减轻重金属铊引起的中毒。比较键角大小:
可减轻重金属铊引起的中毒。比较键角大小: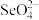
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是(3)
 广泛应用于太阳能电池领域。以
广泛应用于太阳能电池领域。以 、
、 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图1所示,
。抗坏血酸的分子结构如图1所示, 晶胞如图2所示。
晶胞如图2所示。
①抗坏血酸的分子式是
 的价层电子轨道表示式为
的价层电子轨道表示式为②下列说法中
A.抗坏血酸分子中碳原子的轨道杂化类型为

B.抗坏血酸难溶于水,易溶于乙醇
C.抗坏血酸与足量氢气完全催化还原后的分子中有5个手性碳原子
D.
 在水溶液中以
在水溶液中以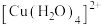 形式存在,
形式存在,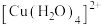 的配位原子为
的配位原子为
③
 晶胞为立方体,边长为
晶胞为立方体,边长为 ,设
,设 为阿伏加德罗常数的值,则晶胞的密度
为阿伏加德罗常数的值,则晶胞的密度
 。
。
您最近一年使用:0次



