1 . I.表中列出了第三周期的几种元素的部分性质:
请按要求回答下列问题:
(1)写出基态a原子的价层电子排布式:____ 。
(2)表中元素原子半径最大的是(写元素符号)_____ 。
(3)a、b、c三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)_____ 。
(4)d、e最高价氧化物对应水化物相互反应的离子方程式为_____ 。
(5)表中五种元素的第一电离能由大到小的顺序是(写元素符号)____ 。
II.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(6)Se原子结构示意图可表示为____ 。
(7)下列说法合理的是____ 。
a.SeO2既有氧化性又有还原性 b.沸点:H2O<H2S<H2Se
c.热稳定性:H2Se<HCl<H2S d.酸性:H2SeO4<HBrO4<HClO4
| 元素编号 | a | b | c | d | e |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)写出基态a原子的价层电子排布式:
(2)表中元素原子半径最大的是(写元素符号)
(3)a、b、c三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)
(4)d、e最高价氧化物对应水化物相互反应的离子方程式为
(5)表中五种元素的第一电离能由大到小的顺序是(写元素符号)
II.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(6)Se原子结构示意图可表示为
(7)下列说法合理的是
a.SeO2既有氧化性又有还原性 b.沸点:H2O<H2S<H2Se
c.热稳定性:H2Se<HCl<H2S d.酸性:H2SeO4<HBrO4<HClO4
您最近一年使用:0次
名校
2 . 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分。
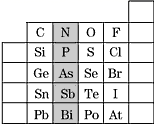
(1)上图中元素N在元素周期表中的位置为_________________ ,根据元素周期律,请预测H3AsO4、H3PO4的酸性强弱:H3AsO4________ H3PO4(填“强于”或“弱于”)。
(2)上图中元素O、S、Se的氢化物的沸点由高到低为:________>________>________。(用化学式填写)_____________
(3)写出S2-的离子结构示意图为______________ ;判断表中Bi和Te两种元素的金属性强弱:Bi________ Te(填“<”或“>”或“=”)。
(4)Br2具有较强的氧化性,SO2具有较强的还原性,请写出将SO2气体通入溴水中反应的离子方程式:________________________________ 。

(1)上图中元素N在元素周期表中的位置为
(2)上图中元素O、S、Se的氢化物的沸点由高到低为:________>________>________。(用化学式填写)
(3)写出S2-的离子结构示意图为
(4)Br2具有较强的氧化性,SO2具有较强的还原性,请写出将SO2气体通入溴水中反应的离子方程式:
您最近一年使用:0次
解题方法
3 . A、B、C、D、E为前四周期元素,且原子序数依次增大
(1)C元素位于第___________ 周期___________ 族,B元素的核外电子排布式为___________ ,E元素的价电子排布图为___________ 。
(2)B、C两元素的电负性大小关系为:___________ (用元素符号表示),A、B的最简单气态氢化物的稳定性强弱大小关系为:___________ (用氢化物的化学式表示)。
(3)B的氢化物由固体变为气态所需克服的微粒间的作用有___________ 。
(4)有A、B、C三种元素及氢元素组成的既含离子键又含共价键且其中元素C显最高价的酸式盐的化学式是___________ 。
(5)D2B2的电子式为___________ ,与CO2反应生成B的单质的化学方程式为:___________ 。
(6)E2O72-具有强氧化性,可与含有C元素的某种还原性离子反应(该离子中C元素显+4价),在酸性条件下该反应的离子方程式为:___________
| A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| B | 地壳中含量最多的元素,2P轨道上有二个孤电子 |
| C | 与B同主族 |
| D | 前四周期中金属性最强的元素 |
| E | 前四周期中原子核外孤电子数最多 |
(2)B、C两元素的电负性大小关系为:
(3)B的氢化物由固体变为气态所需克服的微粒间的作用有
(4)有A、B、C三种元素及氢元素组成的既含离子键又含共价键且其中元素C显最高价的酸式盐的化学式是
(5)D2B2的电子式为
(6)E2O72-具有强氧化性,可与含有C元素的某种还原性离子反应(该离子中C元素显+4价),在酸性条件下该反应的离子方程式为:
您最近一年使用:0次
名校
4 . 短周期元素W、X、Y、Z的原子序数依次增大,其中基态W原子的s能级电子总数是p能级电子总数的2倍,Y与W同主族,X的最简单氢化物的水溶液呈碱性,基态Z原子的核外电子中只有一个未成对电子。下列说法错误的是
| A.电负性:Z>W>Y | B.最简单氢化物的沸点:X>W>Y |
| C.原子半径:Y>W>X | D.Z的单质具有强氧化性 |
您最近一年使用:0次
名校
解题方法
5 . 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH和原子半径、原子序数的关系如图所示。下列说法不正确的是
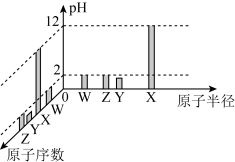

| A.电负性:Z>Y>X |
| B.简单离子的半径:Y>Z>W>X |
| C.同浓度氢化物水溶液的酸性:Z<Y |
| D.Z的单质具有强氧化性 |
您最近一年使用:0次
名校
解题方法
6 . 下列有关物质的结构与性质的说法错误的是
A.F的电负性比Cl的大,可推断 的酸性强于 的酸性强于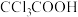 |
| B.HI的分子间作用力比HCl的大,说明HI的热稳定性好 |
| C.H2O2具有氧化性,可推断H2S2也具有氧化性 |
D.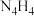 熔融时能导电,说明 熔融时能导电,说明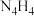 晶体中既含离子键又含共价键 晶体中既含离子键又含共价键 |
您最近一年使用:0次
2022-06-05更新
|
655次组卷
|
5卷引用:湖北省武汉市华中师范大学附属中学2022届高三高考押题化学试题
湖北省武汉市华中师范大学附属中学2022届高三高考押题化学试题(已下线)第15讲 原子结构 化学键(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)T11-物质结构与性质新疆和田地区第二中学2022-2023学年高三上学期11月期中考试化学试题广西玉林市博白县2023-2024学年高三上学期六校联考化学试卷
7 . W、X、Y为同一周期的四种主族元素,原子序数依次增大。基态Y原子的价电子排布为3s23p4,X的电离能数据如下表所示。
(1)Y在元素周期表中的位置是___________ 。
(2)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
资料:ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为 ,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一,水化物的M—O—H结构中,成键原子电负性差异越大,所形成的化学键越容易断。
①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响M—O—H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈___________ (填“酸”或“碱”)性,依据是___________ 。
②W和X的最高价氧化物对应的水化物中,碱性较强的是___________ (写化学式),结合资料说明理由:___________ 。
| 电离能 | 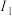 | 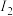 | 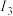 | 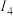 | … |
 | 738 | 1451 | 7733 | 10540 | … |
(2)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
资料:ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为
 ,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一,水化物的M—O—H结构中,成键原子电负性差异越大,所形成的化学键越容易断。
①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响M—O—H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈
②W和X的最高价氧化物对应的水化物中,碱性较强的是
您最近一年使用:0次
2024-02-22更新
|
98次组卷
|
2卷引用:北京市汇文中学2023-2024学年高二上学期期末化学试题
8 . A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其 周期数相同;B的价电子排布式为nsnnpn+2;C、D为同周期元素,C是同周期元素中离子半径最小的元素,D元素最外层有一个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ED4溶液的方法制备纳米材料。
回答下列问题:
(1)D原子的价电子排布图为___________ ,E原子核外有_____ 个未成对电子,五种元素中电负性最大的是___________ (填元素符号)。
(2)化合物D2B的中心原子的杂化方式为______________ ,它的VSEPR模型名称____________ ,分子的立体构型为_____________ 。
(3)与分子晶体D2B3互为等电子体的一种分子为____________ (填化学式)。
(4)由A、B、D三种元素所形成的一系列化合物中氧化性最强的是_______ (填化学式,下同),酸性最强的是_________________ 。
(5)单质B有两种同素异形体,其中沸点高的是______ (填分子式),原因是__________ 。
(6)C与D能形成化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的化学式为____________________ 。
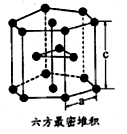
(7)E单质有两种同素异形体,高温下是体心立方堆积,但在常温下的晶体结构为如图所示的六方最密堆积。已知晶胞参数分别为acm和ccm,则该晶体的密度可表示为______ g·cm-3。(用含a和c的式子表示,用NA表示阿伏伽德罗常数的值)。
 。
。
回答下列问题:
(1)D原子的价电子排布图为
(2)化合物D2B的中心原子的杂化方式为
(3)与分子晶体D2B3互为等电子体的一种分子为
(4)由A、B、D三种元素所形成的一系列化合物中氧化性最强的是
(5)单质B有两种同素异形体,其中沸点高的是
(6)C与D能形成化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的化学式为
(7)E单质有两种同素异形体,高温下是体心立方堆积,但在常温下的晶体结构为如图所示的六方最密堆积。已知晶胞参数分别为acm和ccm,则该晶体的密度可表示为
 。
。
您最近一年使用:0次
名校
9 . 现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p3; ②[Ne]3s23p4;③1s22s22p63s23p5。则下列有关比较中正确的是
| A.最高正化合价:①>③>② |
| B.单质氧化性:①>②>③ |
| C.电负性:①>③>② |
| D.最高价氧化物的水合物的酸性:③>②>① |
您最近一年使用:0次
2018-01-31更新
|
404次组卷
|
5卷引用:四川省遂宁市2017-2018学年高二上学期期末考试化学试题
四川省遂宁市2017-2018学年高二上学期期末考试化学试题山西省大同市第三中学2017-2018学年高二下学期4月月考化学试题内蒙古集宁一中2017-2018学年高二下学期第二次月考理科考试综合化学试题(已下线)云南省昆明市官渡区第二中学2023-2024学年高三上学期开学化学试题湖北省十堰市六县市区一中教联体2023-2024学年高二上学期12月联考化学试题
名校
解题方法
10 . 对 Na 、Mg 、Al 的有关性质的叙述不正确的是
| A.第一电离能:Na<Mg<Al |
| B.电负性:Na<Mg<Al |
| C.还原性:Na>Mg>Al |
| D.最高价氧化物的水化物碱性:NaOH>Mg(OH)2>Al(OH)3 |
您最近一年使用:0次
2022-11-02更新
|
142次组卷
|
2卷引用:河北省保定高碑店市崇德实验中学2022-2023学年高三上学期10月月考化学试题



