名校
解题方法
1 . 对Na、Mg、Al的有关性质的叙述正确的是:
| A.碱性:NaOH< Mg(OH)2< Al(OH)3 | B.第一电离能:Na< Mg <Al |
| C.还原性:Na> Mg >Al | D.电负性:Na> Mg >Al |
您最近一年使用:0次
2020-11-12更新
|
566次组卷
|
63卷引用:2015-2016学年山东省淄博市高青一中高二4月月考化学试卷
2015-2016学年山东省淄博市高青一中高二4月月考化学试卷山东省泰安市宁阳一中2018-2019学年高二上学期阶段性考试三(12月)化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题(已下线)09—10年泰州中学高二下学期期末考试化学卷(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015宁夏银川市唐徕回民中学高二下学期3月月考化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A2014-2015学年吉林省汪清县第六中学高二下学期期末考试化学试卷2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷2015-2016学年宁夏六盘山中学高二下第一次月考化学卷2015-2016学年山西太原五中高二下3月第二次周练化学卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年吉林东北师大附属实验高二下期末化学试卷2015-2016学年吉林梅河口五中高二下期末化学试卷2015-2016吉林东北师大附属实验学校净月实验学校高二下期末化学卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷2016-2017学年四川省阆中中学高二上教学质检化学试卷2016-2017学年宁夏吴忠中学高二下学期第一次月考化学试卷2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷安徽省蚌埠市第二中学2016-2017学年高二下学期期中考试化学试题河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题湖北省孝感市七校教学联盟2016-2017学年高二下学期期末考试化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县(市)协作校2016-2017学年高二下学期期末考试化学试题河北省深州中学2016-2017学年高二下学期期末考试化学试题内蒙古包头市第三十三中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县协作校2016-2017学年高二下学期期末化学试题吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题福建省福州三中2017-2018学年高二上学期期末考试化学试题云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题黑龙江省鸡西市鸡东县第二中学2018-2019学年高二5月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期期末考试化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题2020届高三化学二轮物质结构题型专攻——原子结构与性质【基础专练】黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题吉林省延边市长白山第一高级中学2019-2020学年高二下学期验收考试化学试卷吉林省长春市第二十九中学2019-2020学年高二上学期期末考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题四川省平昌县驷马中学2020-2021学年高二上学期九月月考化学试题江苏省东台创新高级中学2019-2020学年高二下学期4月份月检测化学试题四川省乐山十校2020-2021学年高二上学期半期联考化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题河南省宏力学校2018-2019学年高二下学期期中考试化学试题内蒙古集宁新世纪中学2020-2021学年高二下学期期末考试化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题新疆博尔塔拉蒙古自治州蒙古中学2020-2021学年高二下学期期中考试化学试题 四川省绵阳第一中学2022-2023学年高二上学期9月教学质量监测理科化学试题福建省永春美岭中学2021-2022学年高二下学期期中测试化学试题新疆乌鲁木齐市第101中学2021-2022学年高二下学期期末考试化学试题四川省乐山市沫若中学2022-2023学年高二上学期第一次月考化学试题云南省广南县二中2021-2022年学年高二下学期开学考试化学试题河南省焦作市2022-2023学年第四中学高二下学期3月月考 化学试卷新疆阿克苏市实验中学2022-2023学年高二下学期第一次月考化学试题
2 . 前四周期元素X、Y、Z、W的原子序数依次增大,X原子中有6个运动状态不同的电子,Y是地壳中含量最多的元素,基态Z原子K、L层上的电子总数是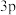 原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
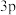 原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是A.电负性: ,原子半径: ,原子半径: | B.同周期中,元素Z的第一电离能最大 |
C.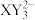 离子中存在 离子中存在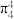 的离域π键 的离域π键 | D.在一定条件下,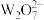 和 和 均具有强氧化性 均具有强氧化性 |
您最近一年使用:0次
真题
名校
3 . 日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2:1:3。下列说法正确的是
| A.电负性:X>Y>Z>W |
| B.原子半径:X<Y<Z<W |
| C.Y和W的单质都能与水反应生成气体 |
| D.Z元素最高价氧化物对应的水化物具有强氧化性 |
您最近一年使用:0次
2023-06-16更新
|
11014次组卷
|
25卷引用:山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题
山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题2023年高考湖南卷化学真题(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)2023年湖南卷高考真题变式题(选择题6-10)(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第19讲元素周期律与元素周期表安徽省亳州市第二完全中学2022-2023学年高二下学期期末考试化学(A卷)试题(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)湖北省武汉市第六中学2023-2024学年高三上学期第一次月考化学试题江西省宜春市宜丰中学2023-2024学年高三上学期开学考试化学试题天津市耀华中学2023-2024学年高三上学期第一次月考化学试题(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)福建省厦门第一中学2024届高三上学期10 月月考化学试题河北省迁安市2023-2024学年高三上学期期中考试化学试题福州市福州高级中学2023-2024学年高三上学期10月月考化学试题福建省厦门第一中学2024届高三上学期第一次月考化学试题重庆市第七中学校2023-2024学年高三上学期11月月考化学试卷北京市第二十中学2023-2024学年高三上学期10月月考化学试题(已下线)题型01 元素位-构-性推断-2024年高考化学答题技巧与模板构建(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)福建省福州高级中学2023-2024学年高三上学期第一阶段考试化学试卷(已下线)FHgkyldyjhx12
4 . 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某钢铁厂烟灰(主要成分为ZnO,并含少量的CuO、MnO2、Fe2O3)为原料制备氧化锌的工艺流程如下:
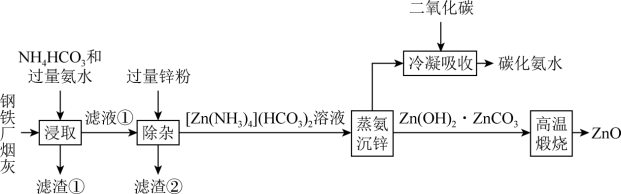
已知:①“浸取”时,ZnO转化为可溶性[Zn(NH3)4]2+离子, 转化为可溶性[Cu(NH3) 4]2+离子;②常温下,
转化为可溶性[Cu(NH3) 4]2+离子;②常温下,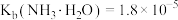 ,
,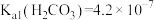 ,
,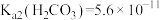 。
。
回答下列问题:
(1)基态Mn原子价层电子轨道表示式为___________ 。
(2)NH4HCO3所含元素的电负性由小到大的顺序为___________ ,“浸取”时加入的NH4HCO3溶液显___________ (填“酸性”、“碱性”或“中性”)。
(3)“除杂”加入过量锌粉发生的离子方程式为___________ ;“冷凝吸收”过程中通入过量CO2,发生反应的离子方程式为:___________ 。
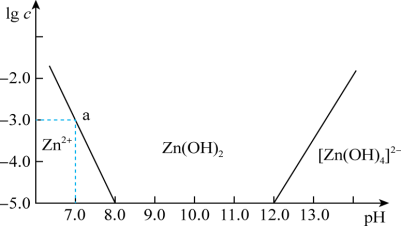
(4)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的 ,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数(假设Zn2+离子浓度
,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数(假设Zn2+离子浓度 时,Zn2+离子已沉淀完全)。从图中数据计算可得Zn(OH)2的溶度积Ksp=
时,Zn2+离子已沉淀完全)。从图中数据计算可得Zn(OH)2的溶度积Ksp=___________ ,某废液中含Zn2+离子,为沉淀Zn2+离子可以控制溶液中pH值的范围是___________ 。

已知:①“浸取”时,ZnO转化为可溶性[Zn(NH3)4]2+离子,
 转化为可溶性[Cu(NH3) 4]2+离子;②常温下,
转化为可溶性[Cu(NH3) 4]2+离子;②常温下,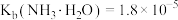 ,
,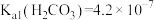 ,
,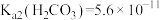 。
。回答下列问题:
(1)基态Mn原子价层电子轨道表示式为
(2)NH4HCO3所含元素的电负性由小到大的顺序为
(3)“除杂”加入过量锌粉发生的离子方程式为
(4)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的
 ,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数(假设Zn2+离子浓度
,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数(假设Zn2+离子浓度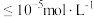 时,Zn2+离子已沉淀完全)。从图中数据计算可得Zn(OH)2的溶度积Ksp=
时,Zn2+离子已沉淀完全)。从图中数据计算可得Zn(OH)2的溶度积Ksp=
您最近一年使用:0次
名校
5 . 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某钢铁厂烟灰(主要成分为 ,并含少量的
,并含少量的 、
、 、
、 )为原料制备氧化锌的工艺流程如下:
)为原料制备氧化锌的工艺流程如下:

已知:①“浸取”时, 转化为可溶性
转化为可溶性 离子,
离子, 转化为可溶性
转化为可溶性 离子;②常温下,
离子;②常温下,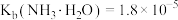 ,
,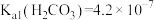 ,
,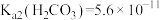 。
。
回答下列问题:
(1) 在周期表中的位置为
在周期表中的位置为_______ ,其基态原子价层电子轨道表示式为_______ 。
(2) 所含元素的电负性由大到小的顺序为
所含元素的电负性由大到小的顺序为_______ ,“浸取”时加入的 溶液显
溶液显_______ (填“酸性”、“碱性”或“中性”)。
(3)“除杂”加入过量锌粉发生的离子方程式为_______ ;“冷凝吸收”过程中通入过量 ,发生反应的离子方程式为:
,发生反应的离子方程式为:_______ 。
(4)常温下二价锌在水溶液中的存在形式与 的关系如图,横坐标为溶液的
的关系如图,横坐标为溶液的 ,纵坐标为
,纵坐标为 或
或 物质的量浓度的对数(假设
物质的量浓度的对数(假设 离子浓度
离子浓度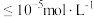 时,
时, 离子已沉淀完全)。从图中数据计算可得
离子已沉淀完全)。从图中数据计算可得 的溶度积
的溶度积
_______ ,某废液中含 离子,为沉淀
离子,为沉淀 离子可以控制溶液中
离子可以控制溶液中 值的范围是
值的范围是_______ 。

 ,并含少量的
,并含少量的 、
、 、
、 )为原料制备氧化锌的工艺流程如下:
)为原料制备氧化锌的工艺流程如下:
已知:①“浸取”时,
 转化为可溶性
转化为可溶性 离子,
离子, 转化为可溶性
转化为可溶性 离子;②常温下,
离子;②常温下,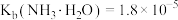 ,
,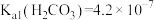 ,
,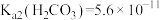 。
。回答下列问题:
(1)
 在周期表中的位置为
在周期表中的位置为(2)
 所含元素的电负性由大到小的顺序为
所含元素的电负性由大到小的顺序为 溶液显
溶液显(3)“除杂”加入过量锌粉发生的离子方程式为
 ,发生反应的离子方程式为:
,发生反应的离子方程式为:(4)常温下二价锌在水溶液中的存在形式与
 的关系如图,横坐标为溶液的
的关系如图,横坐标为溶液的 ,纵坐标为
,纵坐标为 或
或 物质的量浓度的对数(假设
物质的量浓度的对数(假设 离子浓度
离子浓度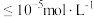 时,
时, 离子已沉淀完全)。从图中数据计算可得
离子已沉淀完全)。从图中数据计算可得 的溶度积
的溶度积
 离子,为沉淀
离子,为沉淀 离子可以控制溶液中
离子可以控制溶液中 值的范围是
值的范围是
您最近一年使用:0次
2022-01-27更新
|
443次组卷
|
3卷引用:山东省济宁市2021-2022学年高二上学期期末考试化学试题
名校
6 . 短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是( )

| A.Y、Z、W三种元素电负性:W>Z>Y |
| B.Y、Z、W三种元素的第一电离能:W>Z>Y |
| C.Y、Z、W与氢元素均可形成含非极性键的二元化合物 |
| D.由X、Y、Z、W构成的化合物中可能含有离子键 |
您最近一年使用:0次
2020-11-25更新
|
489次组卷
|
5卷引用:山东省济南市第一中学2021届高三上学期期中考试化学试题
名校
解题方法
7 . 铁氧体是一种磁性材料,具有广泛的应用。
(1)铁元素位于元素周期表的_________ 区,其基态原子有___________ 种能量不同的电子。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是________ ,醋酸钠中碳原子的杂化类型是_______ 。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解, 的结构式为
的结构式为___________ (标出配位键),与 互为等电子体的分子有
互为等电子体的分子有____________ (任写一种)。铵盐大多不稳定,NH4F、NH4I中,较易分解的是_______________ 。
(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。
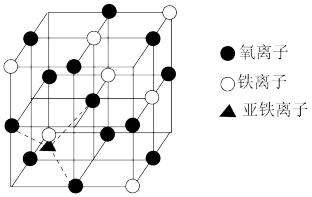
①晶胞中亚铁离子处于氧离子围成的_______________ (填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为______ 。
③解释Fe3O4晶体能导电的原因_________ ;若晶胞的体对角线长为a nm,则Fe3O4晶体的密度为_____________ g·cm-3(阿伏加 德罗常数用NA表示)。
(1)铁元素位于元素周期表的
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,
 的结构式为
的结构式为 互为等电子体的分子有
互为等电子体的分子有(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。

①晶胞中亚铁离子处于氧离子围成的
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为
③解释Fe3O4晶体能导电的原因
您最近一年使用:0次
2020-07-02更新
|
231次组卷
|
3卷引用:山东省实验中学2020届高三下学期打靶模拟考试化学试题
山东省实验中学2020届高三下学期打靶模拟考试化学试题(已下线)第18周 晚练题-备战2022年高考化学周测与晚练(新高考专用)广东省韶关市北江中等职业学校等九校 2021-2022学年高三上学期11月联考化学试题



