名校
解题方法
1 . 铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)画出基态Cu原子的价电子排布图__________________ ;
(2)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因_________________________________________________________________________ 。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是____________ ,配体中提供孤对电子的原子是____________ 。C、N、O三元素的第一电离能由大到小的顺序是__________ (用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示,则晶体铜原子的堆积方式为________________ 。
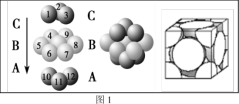
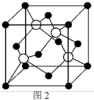
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(白球代表铜原子)。
①该晶体的化学式为_________________ 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于_________ 化合物(填“离子”、“共价”)
③已知该晶体的密度为 g/cm3,阿伏伽德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为
g/cm3,阿伏伽德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________ pm(写出计算式)。
(1)画出基态Cu原子的价电子排布图
(2)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是
(4)铜晶体中铜原子的堆积方式如图1所示,则晶体铜原子的堆积方式为


(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(白球代表铜原子)。
①该晶体的化学式为
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于
③已知该晶体的密度为
 g/cm3,阿伏伽德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为
g/cm3,阿伏伽德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为
您最近一年使用:0次
2018-08-29更新
|
712次组卷
|
2卷引用:【全国百强校】重庆市西南大学附属中学校2018届高三第六次月考(3月)理科综合化学试题
名校
2 . 氯仿 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气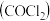 :
: ,下列说法不正确的有
,下列说法不正确的有

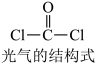
 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气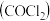 :
: ,下列说法不正确的有
,下列说法不正确的有


A. 分子为含极性键的非极性分子 分子为含极性键的非极性分子 |
B. 分子中含有3个 分子中含有3个 键、一个 键、一个 键,中心C原子采用 键,中心C原子采用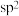 杂化 杂化 |
C. 分子中所有原子的最外层电子都满足8电子稳定结构 分子中所有原子的最外层电子都满足8电子稳定结构 |
| D.使用前可用硝酸银稀溶液检验氯仿是否变质 |
您最近一年使用:0次
2018-07-20更新
|
782次组卷
|
19卷引用:【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期末考试化学试题
【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期末考试化学试题湖北省黄冈市浠水实验高中2019—2020学年高二上学期12月月考化学试题山西省实验中学2019-2020学年高二下学期第一次月考化学试题贵州省思南中学2019-2020学年高二下学期期中考试化学试题四川省江油市第一中学2020-2021学年高二上学期期中考试化学试题重庆市三峡名校联盟2021-2022学年高二下学期春季联考化学试题重庆市三峡名校联盟2021-2022学年高二下学期5月联考化学试题黑龙江省大庆中学2020—2021学年高二下学期第一次月考化学试题福建省莆田第二十五中学2020-2021学年高二下学期期中考试化学试题天津市武清区杨村第一中学2021-2022学年高二下学期第一次月考化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)江西省景德镇一中2022-2023学年高二上学期期中考试化学试题浙江省丽水外国语学校高中部2021-2022学年高二下学期第一次阶段性考试(3月)化学试题河北省衡水市第十四中学2022-2023学年高二下学期第二次考试化学试题广西钦州市第一中学2022-2023学年高二下学期期中考试化学试题广东华侨中学2022-2023学年高二下学期4月期中化学试题广西壮族自治区钦州市第四中学2022-2023学年高二下学期3月月考化学试卷云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题云南省保山第一中学2022-2023学年高二下学期期末考试化学试题
解题方法
3 . [Cu(NH3)4]SO4·H2O是一种重要的染料及合成农药中间体。 请回答下列问题:
(1)[Cu(NH3)4]2+在水溶液中的颜色是________ 。
(2)NH3中N原子的杂化轨道类型是________ 。
(3)Cu2+基态核外电子排布式为_________________ 。
(4)[Cu(NH3)4]SO4中存在的化学键类型除了极性共价键外,还有________ 。
(5)S、O、N三种元素的第一电离能由大到小的顺序为_____________ 。
(6)将金属铜投入到氨水和H2O2的混合溶液中,铜片溶解,溶液是深蓝色,其反应的离子方程式为________ 。
(7)铜氮合金的晶胞结构如图所示,该晶胞中距离最近的铜原子和氮原子核间的距离为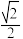 a pm,则该晶体的密度为
a pm,则该晶体的密度为________ g/cm3( 设NA为阿伏伽德罗常数值)。
(1)[Cu(NH3)4]2+在水溶液中的颜色是
(2)NH3中N原子的杂化轨道类型是
(3)Cu2+基态核外电子排布式为
(4)[Cu(NH3)4]SO4中存在的化学键类型除了极性共价键外,还有
(5)S、O、N三种元素的第一电离能由大到小的顺序为
(6)将金属铜投入到氨水和H2O2的混合溶液中,铜片溶解,溶液是深蓝色,其反应的离子方程式为
(7)铜氮合金的晶胞结构如图所示,该晶胞中距离最近的铜原子和氮原子核间的距离为
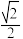 a pm,则该晶体的密度为
a pm,则该晶体的密度为
您最近一年使用:0次
名校
解题方法
4 . A、B、C、D、E为原子序数依次增大的前四周期元素,A是原子半径最小的元素,B元素有两个未成对电子,D元素的最外层电子是内层电子数的三倍,E的单质是自然界中最硬的金属,常用于制作合金,且其未成对电子数在同周期中最多。回答下列问题:
(1)利用原子发生跃迁时吸收或释放出的光用于鉴定E元素,该方法是________ ,其价层电子排布图为____________ ,根据_____________ 原理,该基态原子的电子排布应使其能量处于最低状态。
(2)根据电子排布,C元素处于周期表中_______ 区;根据元素周期律,电负性B_______ C,第一电离能C________ D(填“大于”、“小于”或者“等于”)。
(3)化合物A2D分子空间构型是_____________ ;A与C以原子个数比2:1形成的分子中C原子的杂化方式为_________ ,它是_________ 分子(填“极性”或“非极性”),且该分子可以与很多金属离子形成配合物,其中提供孤对电子的原子是____________ (填元素符号)。
(4)生活中常见的B元素的同素异形体有两种,其结构为图1、图2所示:
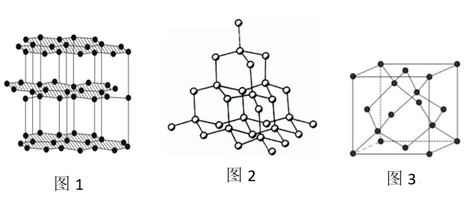
①图1所对应的同素异形体可以导电,试从其结构予以解释_________ 。
②图2所对应的同素异形体的晶胞如图3,若B原子的半径为a nm,则该晶胞的空间利用率为_____________ 。(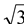 =1.732,结果保留一位小数)
=1.732,结果保留一位小数)
(1)利用原子发生跃迁时吸收或释放出的光用于鉴定E元素,该方法是
(2)根据电子排布,C元素处于周期表中
(3)化合物A2D分子空间构型是
(4)生活中常见的B元素的同素异形体有两种,其结构为图1、图2所示:

①图1所对应的同素异形体可以导电,试从其结构予以解释
②图2所对应的同素异形体的晶胞如图3,若B原子的半径为a nm,则该晶胞的空间利用率为
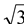 =1.732,结果保留一位小数)
=1.732,结果保留一位小数)
您最近一年使用:0次
名校
解题方法
5 . 钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________ ,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________ 种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________ 。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________ 。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
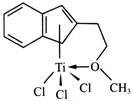
①组成M的元素中,电负性最大的是_________ (填名称)。
②M中碳原子的杂化方式为____________ 。
③M中不含________ (填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
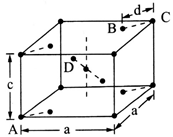
①A、B、C、D 4种微粒,其中氧原子是________ (填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____ ,___ );钛氧键的键长d=______ (用代数式表示)。
(1)基态钛原子的价电子排布式为
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。

①组成M的元素中,电负性最大的是
②M中碳原子的杂化方式为
③M中不含
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。

①A、B、C、D 4种微粒,其中氧原子是
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,
您最近一年使用:0次
2018-05-28更新
|
614次组卷
|
6卷引用:重庆市2019-2020学年高三下学期网络考试化学试题
名校
解题方法
6 . (1)基态溴原子的核外电子排布式为________ ,其核外电子所占用的最高能级电子云形状为_________ 。
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有_____ ,σ键与π键数目之比为______ 。
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是_____ (填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4) NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_______ 。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
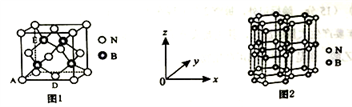
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0, 0),D为(0.5,0.5, 0),则E原子的坐标参数为________ 。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为___ pm.
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4) NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0, 0),D为(0.5,0.5, 0),则E原子的坐标参数为
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为
您最近一年使用:0次
解题方法
7 . 磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:
(1)画出基态P 原子的核外电子排布图__________ 。
(2)NH3比PH3 易液化的原因是_________ 。
(3)P4S3可用于制造火柴,其结构如图1所示。

①P4S3中硫原子的杂化轨道类型为________ 。
②电负性: 磷_____ 硫(填“>”或“<”);第一电离能磷大于硫的原因是________ 。
(4)NH4BF4是合成氮化硼纳米管的原料之一,1mol NH4BF4中含有____ mol 配位键。
(5)NF3的键角小于NH3的键角,其原因是____________ 。
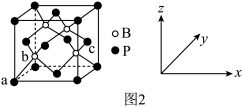
(6)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2 所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a 点和c 点的原子坐标参数依次为(0,0,0)、(1, ,
, ),则b点的原子坐标参数为
),则b点的原子坐标参数为________ ;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____ g.cm-3(阿伏伽德罗常数用NA表示,列出计算式即可)。
(1)画出基态P 原子的核外电子排布图
(2)NH3比PH3 易液化的原因是
(3)P4S3可用于制造火柴,其结构如图1所示。

①P4S3中硫原子的杂化轨道类型为
②电负性: 磷
(4)NH4BF4是合成氮化硼纳米管的原料之一,1mol NH4BF4中含有
(5)NF3的键角小于NH3的键角,其原因是
(6)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2 所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a 点和c 点的原子坐标参数依次为(0,0,0)、(1,
 ,
, ),则b点的原子坐标参数为
),则b点的原子坐标参数为
您最近一年使用:0次
解题方法
8 . C、N、O、Si、P、Ge、As及其化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)基态氮原子核外电子占据的原子轨道数目为_________________ 。
(2)图1表示碳、硅和磷三种元素的四级电离能变化趋势,其中表示磷的曲线是___ (填标号)。

(3)NH3的沸点比PH3高,原因是___________________________ 。
(4)根据等电子原理,NO+电子式为______________ 。
(5)Na3AsO4 中AsO43-的空间构型为______________ ,As4O6的分子结构如图2所示,则在该化合物中As的杂化方式是______________ 。
(6)锗的某种氧化物晶胞结构如图3所示,该物质的化学式为____________ 。已知该晶体密度为7.4g/cm3,晶胞边长为4.31×10-10m。则锗的相对原子质量为____________ (保留小数点后一位)。(已知:O的相对原子质量为16,4.313=80,NA=6.02×1023mol-1)
(1)基态氮原子核外电子占据的原子轨道数目为
(2)图1表示碳、硅和磷三种元素的四级电离能变化趋势,其中表示磷的曲线是

(3)NH3的沸点比PH3高,原因是
(4)根据等电子原理,NO+电子式为
(5)Na3AsO4 中AsO43-的空间构型为
(6)锗的某种氧化物晶胞结构如图3所示,该物质的化学式为
您最近一年使用:0次
名校
解题方法
9 . 碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1) 在第二周期的元素中,第一电离能介于B 与N之间的元素有_________ 种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是____________________ 。
(3)Fe 与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________ 。请写出一个与CO互为等电子体的离子:____________________ 。
(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH 氧化成CH3COOH,试写出基态铬原子的价层电子排布式:_______________ ;CH3COOH 分子中碳原子的杂化类型为_________________ ;乙醇和丙烷相对分子质量相近,但乙醇的熔、沸点比丙烷高很多,试解释其主要原因:____________________________________ 。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______ ,NH3的VSEPR模型为_______ 。
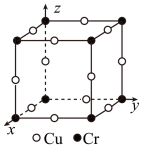
③图为Cu-Cr形成的一种合金的晶胞(假设晶体中原子之间彼此相切),单独属于该晶胞的Cu原子共有三个,其原子坐标可分别表示为:( ,0,0)、 (0,
,0,0)、 (0, ,0)、
,0)、_______ ;已知晶胞中Cr 和Cu原子间的最近距离为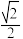 a pm,则该晶体的密度为
a pm,则该晶体的密度为_______ g·cm-3 (用含a的代数式表示,设N A为阿伏伽德罗常数的值)。
(1) 在第二周期的元素中,第一电离能介于B 与N之间的元素有
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是
(3)Fe 与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为
(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH 氧化成CH3COOH,试写出基态铬原子的价层电子排布式:
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为
③图为Cu-Cr形成的一种合金的晶胞(假设晶体中原子之间彼此相切),单独属于该晶胞的Cu原子共有三个,其原子坐标可分别表示为:(
 ,0,0)、 (0,
,0,0)、 (0, ,0)、
,0)、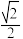 a pm,则该晶体的密度为
a pm,则该晶体的密度为
您最近一年使用:0次
名校
10 . 五水硫酸铜( CuSO4·5H2O) 和六水硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O] 都是重要的化工原料,用途十分广泛。
请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为_______ ;基态铜原子的电子占据的最高能层符号为_______ 。
(2)氧元素的第一电离能小于氮元素,其原因是_______ 。
(3) SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是_______ ;NH4+中氮原子的杂化轨道类型是_______ 。
(4)写出与SO42-互为等电子体的分子的化学式_______ (写一种)。
(5)Cu 与Au 的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu 原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图) 相似,该晶体储氢后的化学式为_______ ,若该晶体的密度为ρg.cm-3,则晶胞中Cu原子与Au原子中心的最短距离d=_______ cm (NA表示阿伏伽德罗常数的值)。

请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为
(2)氧元素的第一电离能小于氮元素,其原因是
(3) SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是
(4)写出与SO42-互为等电子体的分子的化学式
(5)Cu 与Au 的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu 原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图) 相似,该晶体储氢后的化学式为

您最近一年使用:0次
2018-04-17更新
|
385次组卷
|
3卷引用:重庆2018年普通高等学校招生全国统一考试4月调研测试(理综)化学部



