名校
解题方法
1 . 回答下列问题。
(1)青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用溶剂A从中药中提取出来,得到“提取液”后,再经“一系列操作”即可分离出青蒿素,结构如下图所示。下列有关说法正确的有___________
②青蒿素的分子式为C14H20O5
③青蒿素分子中具有的官能团有酮羰基和醚键
④用溶剂A从中药中提取出青蒿素的实验操作是萃取
⑤青蒿素分子中含有7个手性碳原子
(2)化合物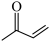 有多种同分异构体,写出满足以下条件的同分异构体结构简式
有多种同分异构体,写出满足以下条件的同分异构体结构简式 ___________ ;写出其与银氨溶液反应的方程式___________ 。
①能与银氨溶液发生反应;②核磁共振氢谱中共含有三组吸收峰。
(3)甘氨酸铜有顺式和反式两种同分异构,结构如图___________ (填序号)
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜不能溶于水,原因可能是___________ 。
(4)C、H、O、N是生命元素。下列说法正确的是___________。
(1)青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用溶剂A从中药中提取出来,得到“提取液”后,再经“一系列操作”即可分离出青蒿素,结构如下图所示。下列有关说法正确的有
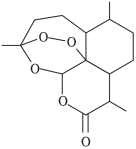
②青蒿素的分子式为C14H20O5
③青蒿素分子中具有的官能团有酮羰基和醚键
④用溶剂A从中药中提取出青蒿素的实验操作是萃取
⑤青蒿素分子中含有7个手性碳原子
(2)化合物
 有多种同分异构体,写出满足以下条件的同分异构体结构简式
有多种同分异构体,写出满足以下条件的同分异构体结构简式 ①能与银氨溶液发生反应;②核磁共振氢谱中共含有三组吸收峰。
(3)甘氨酸铜有顺式和反式两种同分异构,结构如图
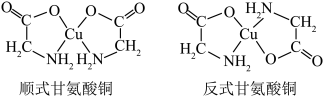
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜不能溶于水,原因可能是
(4)C、H、O、N是生命元素。下列说法正确的是___________。
| A.第一电离能:O>N>C>H |
| B.电负性:O>N>C>H |
C.酸性: |
D.键角: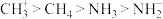 |
您最近一年使用:0次
2 . 中科院大连化学物理研究所科学家用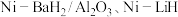 等作催化剂,实现了在常压、
等作催化剂,实现了在常压、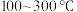 的条件下合成氨,这一成果发表在
的条件下合成氨,这一成果发表在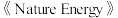 杂志上。
杂志上。
(1)基态Ni2+的价层电子的轨道表示式为___________ ,若该离子核外电子空间运动状态有15种,则该离子处于___________ (填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸 是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中 的空间构型为
的空间构型为___________ 。
②甘氨酸中C原子的杂化方式为___________ ,晶体类型是___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
(3)NH3分子中的键角为107°,但在 中NH3分子的键角如图所示,导致这种变化的原因是
中NH3分子的键角如图所示,导致这种变化的原因是___________ 。___________ mol-1 (列出表达式)。
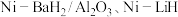 等作催化剂,实现了在常压、
等作催化剂,实现了在常压、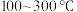 的条件下合成氨,这一成果发表在
的条件下合成氨,这一成果发表在 杂志上。
杂志上。(1)基态Ni2+的价层电子的轨道表示式为
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸
 是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
是组成最简单的氨基酸,熔点为182℃,沸点为233℃。①硝酸溶液中
 的空间构型为
的空间构型为②甘氨酸中C原子的杂化方式为
(3)NH3分子中的键角为107°,但在
 中NH3分子的键角如图所示,导致这种变化的原因是
中NH3分子的键角如图所示,导致这种变化的原因是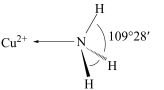
您最近一年使用:0次
3 . 硝基胍是固体火箭推进剂的重要组分,其结构简式如图所示。
(1)硝基胍分子中含有的共价键类型为___________ (从成键方式角度考虑)。
(2)硝基胍分子中C、H、O、N四种元素,这四种元素___________ (填“能”或“不能”)形成离子化合物。
(3)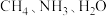 三种分子的中心原子杂化类型相同,但键角大小为
三种分子的中心原子杂化类型相同,但键角大小为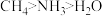 ,原因是
,原因是___________ 。
(4)硝基胍中N原子的杂化方式为___________ 。从结构上分析硝基胍___________ (填“易”或“不”)溶于水,原因是___________ 。
(5)下图中表示的碳原子能量最高的是___________(填字母)。

(1)硝基胍分子中含有的共价键类型为
(2)硝基胍分子中C、H、O、N四种元素,这四种元素
(3)
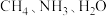 三种分子的中心原子杂化类型相同,但键角大小为
三种分子的中心原子杂化类型相同,但键角大小为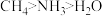 ,原因是
,原因是(4)硝基胍中N原子的杂化方式为
(5)下图中表示的碳原子能量最高的是___________(填字母)。
A.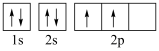 | B.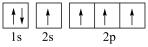 |
C.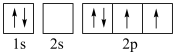 | D.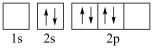 |
您最近一年使用:0次
名校
4 . 合成氨是人类科学技术上的一项重大突破,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献.
(1)自然界中的氮元素主要以分子的形式存在于空气中,是固氮的主要来源.
①基态氮原子的价电子轨道表示式为___________ .
②自然固氮过程中生成的 的
的 模型名称为
模型名称为____________ ,N原子的杂化方式为___________ .
(2)铁触媒是普遍使用的人工合成氨的催化剂,以铁为主体通常还含有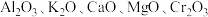 等氧化物.
等氧化物.
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是__________ .
②基态铬原子的电子排布式为___________ .
③下列比较正确的是___________ .
A.第一电离能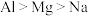 B.熔点:
B.熔点: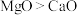
C.离子半径: D.键角:
D.键角: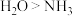
④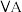 族元素的气态氢化物中
族元素的气态氢化物中 沸点最高的原因是
沸点最高的原因是____________ .
⑤ 和
和 分子的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是
分子的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是_________ 、__________ .
(1)自然界中的氮元素主要以分子的形式存在于空气中,是固氮的主要来源.
①基态氮原子的价电子轨道表示式为
②自然固氮过程中生成的
 的
的 模型名称为
模型名称为(2)铁触媒是普遍使用的人工合成氨的催化剂,以铁为主体通常还含有
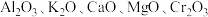 等氧化物.
等氧化物.①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
②基态铬原子的电子排布式为
③下列比较正确的是
A.第一电离能
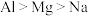 B.熔点:
B.熔点: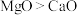
C.离子半径:
 D.键角:
D.键角: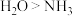
④
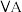 族元素的气态氢化物中
族元素的气态氢化物中 沸点最高的原因是
沸点最高的原因是⑤
 和
和 分子的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是
分子的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是
您最近一年使用:0次
解题方法
5 . 研究元素周期表右上角区域元素,有利于研发新型绿色农药,如 等。
等。
 和
和 的混合气体经光解作用可生成一种新分子
的混合气体经光解作用可生成一种新分子
①
 中S
中S 键。
键。②下列分子中属于非极性分子的是
a. b.
b. c.
c. d.
d.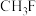 e.
e.
 、
、 中沸点较高的是
中沸点较高的是(3)下列物质变化,只与范德华力有关的是
A.干冰熔化 B.乙酸汽化 C.乙醇与HCHO混溶
D. 溶于水 E.碘溶于四氯化碳
溶于水 E.碘溶于四氯化碳
 。推测酸性:
。推测酸性:
 。
。(5)最近我国某科研团队用磷化钴纳米片催化合成氧化偶氯、偶氯、胺类芳香化合物,反应原理为
 。
。P与N属于同主族元素,但是 不能稳定存在的原因
不能稳定存在的原因
您最近一年使用:0次
解题方法
6 . 按要求回答下列问题:
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是___________ 。
(2)晶体中H2O 和 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为___________ ,试判断 H2O 和  的键角大小关系并说明原因:
的键角大小关系并说明原因:___________ 。
(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为___________ , 雌黄和 SnCl2 在盐酸中反应转化为雄黄(As4S4)和 SnCl4 并放出 H2S 气体。___________ 。
(5)Zn2+的核外电子排布式为___________ ,在元素周期表中,该元素在___________ (填“s”“p”“d”“f”或“ds”)区。。
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,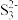 的空间结构为
的空间结构为___________ 。
(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为___________ 。
(8)Na3AsO4 中含有的化学键类型包括___________ ; 的空间结构为
的空间结构为 ___________ 。
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是
(2)晶体中H2O 和
 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为 的键角大小关系并说明原因:
的键角大小关系并说明原因:(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为

(5)Zn2+的核外电子排布式为
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,
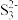 的空间结构为
的空间结构为(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为
(8)Na3AsO4 中含有的化学键类型包括
 的空间结构为
的空间结构为
您最近一年使用:0次
名校
解题方法
7 . 水丰富而独特的性质与其结构密切相关。
(1)对于水分子中的共价键,依据原子轨道重叠的方式判断,属于________ 键;依据O与H的电负性判断,属于______ 共价键。
(2)水分子中,氧原子的价层电子对数为________ ,杂化轨道类型为________ 。
(3)下列事实可用“水分子间存在氢键”解释的是_______ (填字母序号)。
a.接近沸点的水蒸气的相对分子质量测定值比按化学式计算的大一些
b.水的沸点比硫化氢的沸点高
c.水的热稳定性比硫化氢强
(4)水是优良的溶剂,常温常压下 极易溶于水,原因是
极易溶于水,原因是________ (写出两条)。
(5)酸溶于水可形成 ,中心原子O的杂化方式是
,中心原子O的杂化方式是________ ,判断 和
和 的键角大小:
的键角大小:
________  (填“
(填“ ”或“
”或“ ”),理由是
”),理由是________ 。
(1)对于水分子中的共价键,依据原子轨道重叠的方式判断,属于
(2)水分子中,氧原子的价层电子对数为
(3)下列事实可用“水分子间存在氢键”解释的是
a.接近沸点的水蒸气的相对分子质量测定值比按化学式计算的大一些
b.水的沸点比硫化氢的沸点高

c.水的热稳定性比硫化氢强
(4)水是优良的溶剂,常温常压下
 极易溶于水,原因是
极易溶于水,原因是(5)酸溶于水可形成
 ,中心原子O的杂化方式是
,中心原子O的杂化方式是 和
和 的键角大小:
的键角大小:
 (填“
(填“ ”或“
”或“ ”),理由是
”),理由是
您最近一年使用:0次
解题方法
8 . 乙醚是一种极易挥发的无色透明液体。乙醚长时间与空气接触时,逐渐生成过氧化乙醚( )。
)。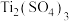 、
、 、
、 可除去过氧化乙醚。回答下列问题:
可除去过氧化乙醚。回答下列问题:
(1)基态 、O、
、O、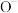 的第一电离能
的第一电离能 按由大到小排序为
按由大到小排序为___________ 。
(2)基态 还原过氧化乙醚时失去的是
还原过氧化乙醚时失去的是___________ 轨道电子,从电负性角度判断 中H的化合价为
中H的化合价为___________ 。 中
中 键的化学键类型为
键的化学键类型为___________ ,中心原子的杂化轨道类型为___________ 。
(3)一个过氧化乙醚分子中,价层电子对数目为4的原子有___________ 个。过氧化乙醚分子中的键能如下:
造成 键键能小于
键键能小于 键键能的可能原因是
键键能的可能原因是___________ 。
(4)乙醚沸点35.6℃,丙酸( )沸点为141℃,两者沸点差异较大的主要原因是
)沸点为141℃,两者沸点差异较大的主要原因是___________ 。
(5)硫酸亚铁的正交晶胞参数为 、
、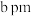 、
、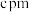 ,
,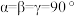 ,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为
,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为 。
。___________  ,晶体密度为
,晶体密度为___________  (列出算式)。
(列出算式)。
 )。
)。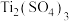 、
、 、
、 可除去过氧化乙醚。回答下列问题:
可除去过氧化乙醚。回答下列问题:(1)基态
 、O、
、O、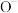 的第一电离能
的第一电离能 按由大到小排序为
按由大到小排序为(2)基态
 还原过氧化乙醚时失去的是
还原过氧化乙醚时失去的是 中H的化合价为
中H的化合价为 中
中 键的化学键类型为
键的化学键类型为(3)一个过氧化乙醚分子中,价层电子对数目为4的原子有
| 单键 |  |  |  |  |  |
键能/( ) ) | 346 | 411 | 358 | 207 | 459 |
 键键能小于
键键能小于 键键能的可能原因是
键键能的可能原因是(4)乙醚沸点35.6℃,丙酸(
 )沸点为141℃,两者沸点差异较大的主要原因是
)沸点为141℃,两者沸点差异较大的主要原因是(5)硫酸亚铁的正交晶胞参数为
 、
、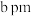 、
、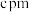 ,
,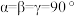 ,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为
,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为 。
。
 ,晶体密度为
,晶体密度为 (列出算式)。
(列出算式)。
您最近一年使用:0次
名校
解题方法
9 . 按要求回答下列问题:
(1)基态钛原子核外共有________ 种空间运动状态不相同的电子。Cu在周期表中的位置为________________________ ,基态Ni2+的价层电子排布式为________________________ ,Zn位于元素周期表的________________ 区。
(2)分子极性:CH4________ NH3(填“>”或“<”),熔沸点:CH4________ NH3(填“>”或“<”),键角:CH4________ NH3(填“>”或“<”)。
(3)组成为 ,配位数为6的晶体有两种。其中一种物质X呈绿色。实验表明,
,配位数为6的晶体有两种。其中一种物质X呈绿色。实验表明, 恰好与
恰好与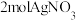 反应生成沉淀。则X的化学式为
反应生成沉淀。则X的化学式为________ 。(表示出内界和外界)
(1)基态钛原子核外共有
(2)分子极性:CH4
(3)组成为
 ,配位数为6的晶体有两种。其中一种物质X呈绿色。实验表明,
,配位数为6的晶体有两种。其中一种物质X呈绿色。实验表明, 恰好与
恰好与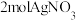 反应生成沉淀。则X的化学式为
反应生成沉淀。则X的化学式为
您最近一年使用:0次
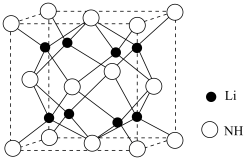
10 . 磷化硼是一种超硬耐磨涂层材料,结构与金刚石相似,其晶胞结构如图所示。请回答下列问题:___________ ,基态磷原子中电子的运动状态有___________ 种,与硼同主族的第四周期元素的基态原子价层电子的轨道表示式为___________ 。
(2) 为一元弱酸,
为一元弱酸, 分子中
分子中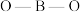 的键角
的键角___________ (填“ ”“
”“ ”或“
”或“ ”)
”) (中的
(中的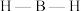 的键角,原因为
的键角,原因为___________ 。
(3)磷化硼晶体属于___________ 晶体,其中硼原子的配位数为___________ 。
(4)磷化硼的化学式为___________ ,该晶体的密度为___________  (用含a、
(用含a、 的代数式表示,阿伏加德罗常数的值为
的代数式表示,阿伏加德罗常数的值为 )。
)。

(2)
 为一元弱酸,
为一元弱酸, 分子中
分子中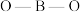 的键角
的键角 ”“
”“ ”或“
”或“ ”)
”) (中的
(中的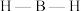 的键角,原因为
的键角,原因为(3)磷化硼晶体属于
(4)磷化硼的化学式为
 (用含a、
(用含a、 的代数式表示,阿伏加德罗常数的值为
的代数式表示,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次



