名校
1 . 2-TS是锂离子电池的电解质溶液添加剂,由原子序数依次增大的五种短周期主族元素X、Y、Z、T、W组成,结构如图所示。T和W位于同主族,基态Y原子核外每个能级上的电子数相等,X、Y、Z的原子序数之和等于14。下列叙述正确的是
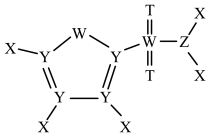
| A.第一电离能:T>Z>W | B.最高价氧化物对应水化物的酸性:Z<Y |
| C.最简单氢化物的键角:Y>T>W | D.X分别与Y、Z、T均可形成非极性分子 |
您最近一年使用:0次
2024-05-07更新
|
121次组卷
|
2卷引用:名校期末好题汇编-分子结构与性质(选择题)
2 . 下列对一些实验事实的解释错误的是
| 选项 | 实验事实 | 解释 |
| A | 水加热到较高温度难以分解 | 水分子中共价键键能较大 |
| B | 石墨棒作为原电池的电极材料 | 石墨晶体能导电 |
| C |  的沸点高于 的沸点高于 | H-N键的键长比H-P键的键长短 |
| D | 用X射线实验区分玻璃和水晶 | 水晶的衍射图上有明锐的衍射峰 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 下列判断及其解释都正确的是
| 选项 | 判断 | 解释 |
| A | 热稳定性: |  相对分子质量大 相对分子质量大 |
| B | 酸性: | 非金属性 大于S 大于S |
| C |  原子s电子云半径: 原子s电子云半径: | 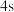 电子的能量高,在离核更远的区域出现的概率大 电子的能量高,在离核更远的区域出现的概率大 |
| D | 键角: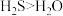 | 电负性O大于S, 中 中 键电子对之间的斥力小于 键电子对之间的斥力小于 中 中 键电子对之间的斥力 键电子对之间的斥力 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-29更新
|
71次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
解题方法
4 . 已知  和
和 可以形成
可以形成 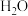 和
和  两种化合物,试根据有关信息完成下列问题:
两种化合物,试根据有关信息完成下列问题:
①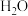 内的
内的 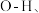 水分子间的范德华力和氢键,从强到弱依次为
水分子间的范德华力和氢键,从强到弱依次为___________ ;
②用球棍模型表示的水分子结构是 ;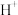 可与
可与 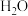 形成
形成 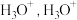 中的
中的 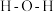 键角比
键角比 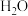 的键角
的键角___________ 。(填“大”或“小”)
(2)已知 分子的结构如图所示:
分子的结构如图所示: 分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角
分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角 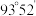 ,而两个
,而两个  键与
键与  键的夹角均为
键的夹角均为 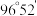 。
。
请回答下列问题:
① 子的电子式是
子的电子式是___________ ,结构式是___________ 。
② 分子是含有
分子是含有___________ 键和___________ 键的___________ (填“极性”或“非极性”)分子。
③ 能与水混溶,却不溶于
能与水混溶,却不溶于  试剂,请予以解释:
试剂,请予以解释:___________ 。
 和
和 可以形成
可以形成  和
和  两种化合物,试根据有关信息完成下列问题:
两种化合物,试根据有关信息完成下列问题: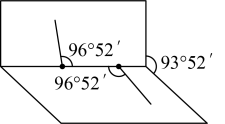
①
 内的
内的 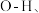 水分子间的范德华力和氢键,从强到弱依次为
水分子间的范德华力和氢键,从强到弱依次为②用球棍模型表示的水分子结构是 ;
A. 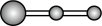 B.
B. 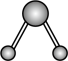 C.
C.  D.
D.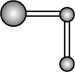
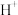 可与
可与 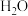 形成
形成 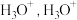 中的
中的 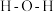 键角比
键角比 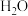 的键角
的键角(2)已知
 分子的结构如图所示:
分子的结构如图所示: 分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角
分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角 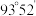 ,而两个
,而两个  键与
键与  键的夹角均为
键的夹角均为 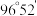 。
。请回答下列问题:
①
 子的电子式是
子的电子式是②
 分子是含有
分子是含有③
 能与水混溶,却不溶于
能与水混溶,却不溶于  试剂,请予以解释:
试剂,请予以解释:
您最近一年使用:0次
5 . 下列关于同主族元素结构性质对比的结论与解释有错误的是
| 选项 | 结论 | 解释 |
| A | 稳定性:H2O﹥H2S | O的半径比S的小 |
| B | 键角:PH3﹤NH3 | PH3的成键电子对间排斥力较小 |
| C | 酸性:HF﹥HCl | F的电负性比Cl大,H-F极性比H-C1大 |
| D | 稳定性:Si原子间的π键﹤C原子间的π键 | Si-Si σ键比C-C σ键的键长长 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 同学们使用的涂改液中含有很多有害的挥发性物质,二氯甲烷就是其中的一种,吸入会引起慢性中毒,有关二氯甲烷的说法正确的是
| A.含有非极性共价键 | B.键角均为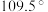 |
| C.有两种同分异构体 | D.分子属于极性分子 |
您最近一年使用:0次
2024-04-27更新
|
41次组卷
|
2卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
7 . 3-氨基-1-金刚烷醇可用于合成药物维格列汀(治疗2型糖尿病),其分子结构如下图所示。下列说法不正确的是

A.分子中O原子和N原子均为 杂化 杂化 | B.分子中的键角: |
C.电负性: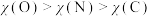 | D.第一电离能: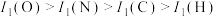 |
您最近一年使用:0次
2024-04-15更新
|
176次组卷
|
2卷引用:黑龙江省大庆市大庆中学2023-2024学年高二下学期4月月考化学试题
名校
8 . 下列说法中正确的是
| A.NO2、SO2、BF3、NCl3分子中每原子的最外层电子都满足了8电子稳定结构 |
| B.P4和CH4都是正四面体形分子且键角都为109°28′ |
C. 中硼原子的杂化类型与苯中碳原子的杂化类型不同 中硼原子的杂化类型与苯中碳原子的杂化类型不同 |
| D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
您最近一年使用:0次
2024-04-09更新
|
94次组卷
|
2卷引用:江西省南昌市第十九中学2023-2024学年高二上学期期末考试化学试卷
9 . 填空
(1)基态铜原子价层电子排布图为______ ﹔已知Cu第一电离能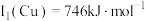 ,Fe第一电离能
,Fe第一电离能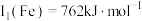 ,则
,则
______  (填“>”、“=”或“<”),其主要原因是
(填“>”、“=”或“<”),其主要原因是______ ;
(2) 和
和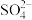 的中心原子的杂化轨道类型分别为
的中心原子的杂化轨道类型分别为______ ,试判断 和
和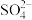 的键角大小关系:
的键角大小关系:
______ 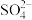 ,说明原因:
,说明原因:______
(3)比较 和
和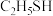 的酸性:
的酸性:
______ 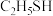 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)基态铜原子价层电子排布图为
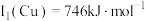 ,Fe第一电离能
,Fe第一电离能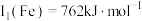 ,则
,则
 (填“>”、“=”或“<”),其主要原因是
(填“>”、“=”或“<”),其主要原因是(2)
 和
和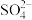 的中心原子的杂化轨道类型分别为
的中心原子的杂化轨道类型分别为 和
和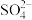 的键角大小关系:
的键角大小关系:
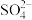 ,说明原因:
,说明原因:(3)比较
 和
和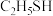 的酸性:
的酸性:
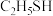 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2024-04-03更新
|
344次组卷
|
2卷引用:浙江省杭州市源清中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
10 . Ⅰ.8−羟基喹啉( )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(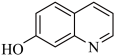 )、6−羟基喹啉(
)、6−羟基喹啉(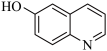 )的熔点的原因是
)的熔点的原因是___________ 。
(2) 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是___________ 。
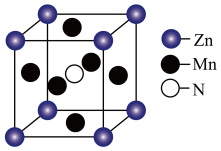
(3)某种含 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ. 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个,与 距离最近且相等的F-有
距离最近且相等的F-有___________ 个。
(5) 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。(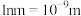 )
)
(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
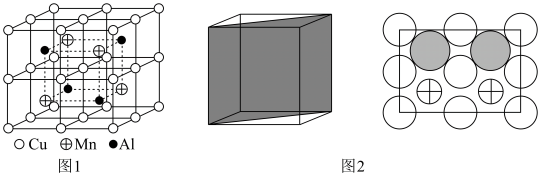
将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
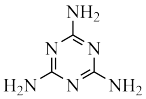
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是___________ 。
 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(
 )、6−羟基喹啉(
)、6−羟基喹啉( )的熔点的原因是
)的熔点的原因是(2)
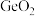 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(3)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ.
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有 距离最近且相等的F-有
距离最近且相等的F-有(5)
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。(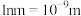 )
)(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
A.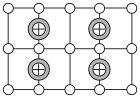 | B.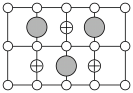 |
C. | D.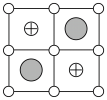 |
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是

您最近一年使用:0次



