名校
1 .  代表阿伏加德罗常数的值。下列说法正确的是
代表阿伏加德罗常数的值。下列说法正确的是
 代表阿伏加德罗常数的值。下列说法正确的是
代表阿伏加德罗常数的值。下列说法正确的是A.11.2L  含π键数目为 含π键数目为 |
B.NaCl和 的混合物中含1mol 的混合物中含1mol  ,则混合物中质子数为28 ,则混合物中质子数为28 |
C.电解熔融 ,阴极增重6.4g,外电路中通过电子的数目为0.1 ,阴极增重6.4g,外电路中通过电子的数目为0.1 |
D.1.7g  完全溶于1L 完全溶于1L  所得的溶液中, 所得的溶液中, 微粒的数目为0.1 微粒的数目为0.1 |
您最近一年使用:0次
7日内更新
|
246次组卷
|
3卷引用:广东省揭阳市2024届高三下学期二模考试化学试题
解题方法
2 . 设NA为阿伏加德罗常数的值。下列说法错误的是
| A.1mol过氧化氢所含的共价键数目为3NA |
B.1mol白磷P4(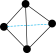 )含6NA个P-P键 )含6NA个P-P键 |
| C.等物质的量的CO2和N2中含有π键的数目均为2NA |
| D.1mol金刚石晶体中含有2NA个C-C键,1mol二氧化硅中含4NA个Si-O键 |
您最近一年使用:0次
名校
3 . 铁、铜都是重要的过渡元素,它们的单质和化合物在生活、生产中有广泛应用。
(1)基态Fe原子价电子轨道表示式为__________________ 。
(2)已知铜的配合物A的结构简式如图所示。 的配位数为
的配位数为________ ,该配合物中的第二周期元素的电负性由大到小的顺序为__________ 。
②配体氨基乙酸根(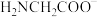 )受热分解可产生
)受热分解可产生 和
和 ,
, 的VSEPR模型名称为
的VSEPR模型名称为_________ 。
(3)亚铁氰化钾,化学式为 ,呈黄色结晶性粉末。
,呈黄色结晶性粉末。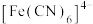 中配体
中配体 的配位原子是
的配位原子是________ (填元素符号), 中C原子的杂化方式为
中C原子的杂化方式为__________ ,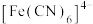 中
中 键和
键和 键的数目之比为
键的数目之比为______ 。
(4) 呈黑色或灰黑色,已知:晶胞中
呈黑色或灰黑色,已知:晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞的侧视图如图2所示。则
所构成的四面体中心,晶胞的侧视图如图2所示。则 配位数为
配位数为_______ 。已知图1中A原子的原子分数坐标为 ,则与A原子距离最近的
,则与A原子距离最近的 的原子分数坐标为
的原子分数坐标为_________ 。
(1)基态Fe原子价电子轨道表示式为
(2)已知铜的配合物A的结构简式如图所示。

 的配位数为
的配位数为②配体氨基乙酸根(
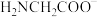 )受热分解可产生
)受热分解可产生 和
和 ,
, 的VSEPR模型名称为
的VSEPR模型名称为(3)亚铁氰化钾,化学式为
 ,呈黄色结晶性粉末。
,呈黄色结晶性粉末。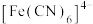 中配体
中配体 的配位原子是
的配位原子是 中C原子的杂化方式为
中C原子的杂化方式为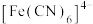 中
中 键和
键和 键的数目之比为
键的数目之比为(4)
 呈黑色或灰黑色,已知:晶胞中
呈黑色或灰黑色,已知:晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞的侧视图如图2所示。则
所构成的四面体中心,晶胞的侧视图如图2所示。则 配位数为
配位数为 ,则与A原子距离最近的
,则与A原子距离最近的 的原子分数坐标为
的原子分数坐标为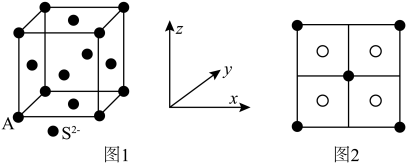
您最近一年使用:0次
4 . 金属钛(Ti)重量轻、强度高、抗腐蚀能力,在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。
(1)基态Ti原子的价电子轨道表示式:______ 。
(2) 转化为
转化为 有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
Ⅰ.

Ⅱ.

已知: 的燃烧热为393.5
的燃烧热为393.5 ',
', 的燃烧热为283.0
的燃烧热为283.0
①
______ 。
②碳氯化反应过程中CO和 可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是
可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是______ 。 生成CO反应为放热反应
生成CO反应为放热反应
B.升高温度, 平衡转化率减小
平衡转化率减小
C.增大压强,碳氯化反应平衡向正反应方向移动
D.如图2所示 晶胞中
晶胞中 位于
位于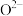 所构成的正八面体的体心,则
所构成的正八面体的体心,则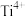 的配位数是6
的配位数是6
③碳氯化法中生成CO比生成 更有利于
更有利于 转化为
转化为 ,从熵变角度分析可能的原因是
,从熵变角度分析可能的原因是______ 。
(3)经光谱分析在碳氯化反应中有光气( )生成,后
)生成,后 继续反应,有理论认为机理如下:
继续反应,有理论认为机理如下: 含有
含有______ 个σ键,决速步骤的反应方程式为______ 。
(4)在 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 的平衡常数
的平衡常数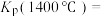
______ Pa。
②图中显示,在200℃平衡时 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是______ 。
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。(1)基态Ti原子的价电子轨道表示式:
(2)
 转化为
转化为 有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。Ⅰ.


Ⅱ.


已知:
 的燃烧热为393.5
的燃烧热为393.5 ',
', 的燃烧热为283.0
的燃烧热为283.0
①

②碳氯化反应过程中CO和
 可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是
可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是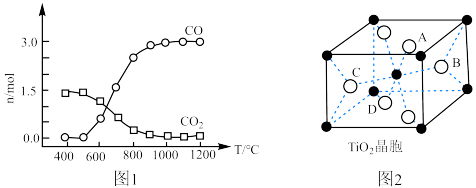
 生成CO反应为放热反应
生成CO反应为放热反应B.升高温度,
 平衡转化率减小
平衡转化率减小C.增大压强,碳氯化反应平衡向正反应方向移动
D.如图2所示
 晶胞中
晶胞中 位于
位于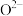 所构成的正八面体的体心,则
所构成的正八面体的体心,则 的配位数是6
的配位数是6③碳氯化法中生成CO比生成
 更有利于
更有利于 转化为
转化为 ,从熵变角度分析可能的原因是
,从熵变角度分析可能的原因是(3)经光谱分析在碳氯化反应中有光气(
 )生成,后
)生成,后 继续反应,有理论认为机理如下:
继续反应,有理论认为机理如下: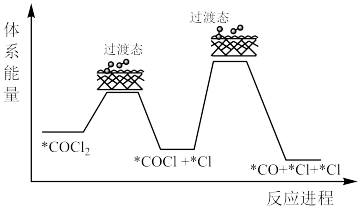
 含有
含有(4)在
 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
 的平衡常数
的平衡常数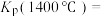
②图中显示,在200℃平衡时
 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是
您最近一年使用:0次
2024-05-20更新
|
588次组卷
|
2卷引用:广东省汕头市2024届高三二模考试化学试
5 . 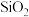 用途广泛。利用
用途广泛。利用 溶液与玻璃中
溶液与玻璃中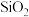 反应生产磨砂玻璃;利用反应
反应生产磨砂玻璃;利用反应 制备
制备 陶瓷。设
陶瓷。设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
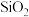 用途广泛。利用
用途广泛。利用 溶液与玻璃中
溶液与玻璃中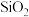 反应生产磨砂玻璃;利用反应
反应生产磨砂玻璃;利用反应 制备
制备 陶瓷。设
陶瓷。设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A. 中所含 中所含 键数目为 键数目为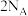 |
B. 的 的 溶液中所含 溶液中所含 数目为 数目为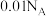 |
C. 与 与 混合气体中所含质子数为 混合气体中所含质子数为 |
D.制备 的反应中,生成 的反应中,生成 时转移电子数为 时转移电子数为 |
您最近一年使用:0次
6 . 下列有关分子结构的描述正确的是
A. 中心原子为 中心原子为 杂化,分子呈三角锥形 杂化,分子呈三角锥形 |
B. 的VSEPR模型为V形 的VSEPR模型为V形 |
| C.HCHO分子为平面三角形,分子中含3个σ键和一个π键 |
D. 为正四面体形分子,能与水分子形成分子间氢键 为正四面体形分子,能与水分子形成分子间氢键 |
您最近一年使用:0次
名校
解题方法
7 . HC≡C-CH=NH是一种星际分子。下列关于该分子结构的说法正确的是
| A.每个分子中含有6个σ键和3个π键 | B.分子中所有碳原子均为sp杂化 |
| C.分子中所有碳原子在同一直线上 | D.氮原子为sp3杂化 |
您最近一年使用:0次
2024-05-09更新
|
73次组卷
|
2卷引用:广东省珠海市第一中学2023-2024学年高二下学期第一阶段考试化学科试题
名校
8 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素符号A:_______ ,B:_______ ,E_______ ,G:_______ 。
(2)C、D、E三种元素的原子半径由大到小的顺序为_______ (用元素符号表示)。
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:_______ ,_______ ,_______ 。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为_______ 。
(5)G元素可形成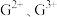 ,其中较稳定的是
,其中较稳定的是 ,试从核外电子排布的角度解释其原因:
,试从核外电子排布的角度解释其原因:_______ 。
(6)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是_______ 化合物(填“离子”或“共价”)。根据“对角线规则”,元素周期表中某些处于对角的元素,它们的化合物性质具有相似性,则M的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为_______ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: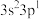 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)C、D、E三种元素的原子半径由大到小的顺序为
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)G元素可形成
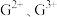 ,其中较稳定的是
,其中较稳定的是 ,试从核外电子排布的角度解释其原因:
,试从核外电子排布的角度解释其原因:(6)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
您最近一年使用:0次
9 . 对氮氧化物 的资源化利用,运用多种方式促进氮的循环转化,具有重要的研究意义。
的资源化利用,运用多种方式促进氮的循环转化,具有重要的研究意义。
(1)已知a:

b:C的燃烧热为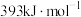 ;
;
c:
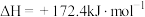
①请写出 与
与 反应生成两种无污染性气体的热化学方程式:
反应生成两种无污染性气体的热化学方程式:_____ 。
②将等物质的量的 与
与 混合气体分别通入体积均为
混合气体分别通入体积均为 的恒温密闭容器Ⅰ和绝热密闭容器Ⅱ中,反应一段时间后两容器内达到平衡状态,下列说法正确的是
的恒温密闭容器Ⅰ和绝热密闭容器Ⅱ中,反应一段时间后两容器内达到平衡状态,下列说法正确的是_____ 。
A.两容器内混合气体密度相等
B. 转化率
转化率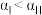
C.反应平衡常数
(2)可利用钴氨配合物吸收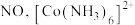 对
对 的配合能力很强,而
的配合能力很强,而 对
对 的配合能力极低。
的配合能力极低。 溶液脱除
溶液脱除 的效率如图1所示,有氧环境下,发生总反应:
的效率如图1所示,有氧环境下,发生总反应: ,在
,在 的有氧环境下,往
的有氧环境下,往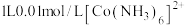 溶液中持续通入试样气体
溶液中持续通入试样气体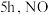 脱除率为60%(假设溶液体积不发生改变),结合图1信息,计算此时钴氨溶液中
脱除率为60%(假设溶液体积不发生改变),结合图1信息,计算此时钴氨溶液中 有效含钴率为
有效含钴率为_____ 。
(有效含钴率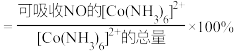 )
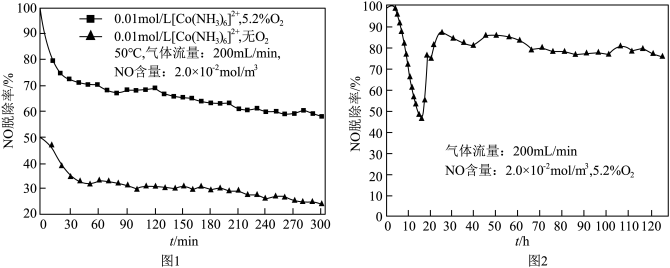
) 后,其吸收
后,其吸收 的能力变化如图2所示,前
的能力变化如图2所示,前 内钴氨溶液吸收
内钴氨溶液吸收 的能力不断下降的原因是
的能力不断下降的原因是_____ 。
(3)催化电解 吸收液可将
吸收液可将 还原为
还原为 ,其催化机理如图3所示,在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率
,其催化机理如图3所示,在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率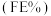 随电解电压的变化如图4所示。已知
随电解电压的变化如图4所示。已知 表示电解生还原产物X所转移电子的物质的量,F表示法拉第常数;
表示电解生还原产物X所转移电子的物质的量,F表示法拉第常数; 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。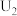 时,催化电解
时,催化电解 生成
生成 的电极反应式为
的电极反应式为_____ 。
②当电解电压为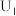 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为_____ 。
 的资源化利用,运用多种方式促进氮的循环转化,具有重要的研究意义。
的资源化利用,运用多种方式促进氮的循环转化,具有重要的研究意义。(1)已知a:


b:C的燃烧热为
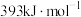 ;
;c:

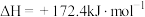
①请写出
 与
与 反应生成两种无污染性气体的热化学方程式:
反应生成两种无污染性气体的热化学方程式:②将等物质的量的
 与
与 混合气体分别通入体积均为
混合气体分别通入体积均为 的恒温密闭容器Ⅰ和绝热密闭容器Ⅱ中,反应一段时间后两容器内达到平衡状态,下列说法正确的是
的恒温密闭容器Ⅰ和绝热密闭容器Ⅱ中,反应一段时间后两容器内达到平衡状态,下列说法正确的是A.两容器内混合气体密度相等
B.
 转化率
转化率
C.反应平衡常数

(2)可利用钴氨配合物吸收
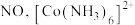 对
对 的配合能力很强,而
的配合能力很强,而 对
对 的配合能力极低。
的配合能力极低。①已知 的结构如图所示
的结构如图所示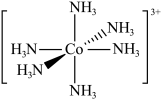 ,
, 中含有
中含有 键的数目是
键的数目是
 溶液脱除
溶液脱除 的效率如图1所示,有氧环境下,发生总反应:
的效率如图1所示,有氧环境下,发生总反应: ,在
,在 的有氧环境下,往
的有氧环境下,往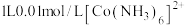 溶液中持续通入试样气体
溶液中持续通入试样气体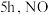 脱除率为60%(假设溶液体积不发生改变),结合图1信息,计算此时钴氨溶液中
脱除率为60%(假设溶液体积不发生改变),结合图1信息,计算此时钴氨溶液中 有效含钴率为
有效含钴率为(有效含钴率
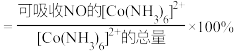 )
)
 后,其吸收
后,其吸收 的能力变化如图2所示,前
的能力变化如图2所示,前 内钴氨溶液吸收
内钴氨溶液吸收 的能力不断下降的原因是
的能力不断下降的原因是(3)催化电解
 吸收液可将
吸收液可将 还原为
还原为 ,其催化机理如图3所示,在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率
,其催化机理如图3所示,在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率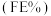 随电解电压的变化如图4所示。已知
随电解电压的变化如图4所示。已知 表示电解生还原产物X所转移电子的物质的量,F表示法拉第常数;
表示电解生还原产物X所转移电子的物质的量,F表示法拉第常数; 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。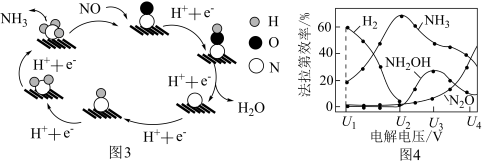
 时,催化电解
时,催化电解 生成
生成 的电极反应式为
的电极反应式为②当电解电压为
 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
10 . 科研人员开发了一种生产药物中间体三氟甲苯的方法: 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
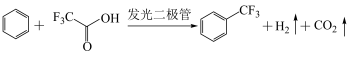
 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是A.1mol三氟甲苯中 键数目为15 键数目为15 |
B.1mol  和 和 组成的混合物中原子总数为2 组成的混合物中原子总数为2 |
C.生成22.4L  时,需消耗1mol苯 时,需消耗1mol苯 |
D.1L 1 三氟乙酸溶液中, 三氟乙酸溶液中, 的数目为 的数目为 |
您最近一年使用:0次



