解题方法
1 . 回答下列问题。
(1)白磷(P4)在氯气中燃烧可生成 PCl3 和 PCl5。
①形成 PCl5时,P 原子的一个 3s 电子激发入 3d 轨道后参与成键,该激发态的价电子排布式为___________ 。
②研究表明,在加压条件下 PCl5 于 148℃液化时能发生与水类似的自偶电离,形成一种能导电的熔体,其电离方程式为___________ ,产生的阳离子的空间结构形状为___________ 。
(2)分子中的大π键可用符号 表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为 )。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为___________ ,一定在同一平面上的原子有___________ 个。乙醇显中性而苯酚显酸性的原因是:___________ 。
(3)硫化锌精矿是冶炼金属锌的主要原料,六方硫化锌(纤锌矿型)的平行六面体晶胞如图 2 所示,晶体中正负离子的配位数之比为___________ 。___________ g•cm-3。
(1)白磷(P4)在氯气中燃烧可生成 PCl3 和 PCl5。
①形成 PCl5时,P 原子的一个 3s 电子激发入 3d 轨道后参与成键,该激发态的价电子排布式为
②研究表明,在加压条件下 PCl5 于 148℃液化时能发生与水类似的自偶电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为 )。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为(3)硫化锌精矿是冶炼金属锌的主要原料,六方硫化锌(纤锌矿型)的平行六面体晶胞如图 2 所示,晶体中正负离子的配位数之比为


您最近一年使用:0次
2024-05-16更新
|
88次组卷
|
2卷引用:专题5 物质结构与性质 元素周期律-晶体结构与性质
2 . 中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料: ,并获得该化合物的LED器件,为白光的应用提供新材料支持。
,并获得该化合物的LED器件,为白光的应用提供新材料支持。
(1)已知 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有__________ 种,基态O原子的电子排布式不能表示为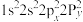 ,因为这违背了
,因为这违背了__________ (填选项)。
A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2) 、P与S是同周期中相邻的元素,
、P与S是同周期中相邻的元素, 、P、S的电负性由大到小的顺序是
、P、S的电负性由大到小的顺序是__________ ,第一电离能由大到小的顺序是__________ .
(3)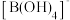 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为__________ 。 中,
中, 与0之间不存在的化学键是
与0之间不存在的化学键是__________ (填选项)。
A. 键 B.
键 B. 键 C.配位键 D.极性键
键 C.配位键 D.极性键
(4)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是__________ ,其原因是_______________ 。
(5)超高热导率半导体材料砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的原子坐标为__________ 。已知阿伏加德罗常数的值为 ,若晶胞中
,若晶胞中 原子到B原子最近距离为
原子到B原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为__________ (列出含a、 的计算式即可)。
的计算式即可)。
 ,并获得该化合物的LED器件,为白光的应用提供新材料支持。
,并获得该化合物的LED器件,为白光的应用提供新材料支持。(1)已知
 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有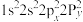 ,因为这违背了
,因为这违背了A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2)
 、P与S是同周期中相邻的元素,
、P与S是同周期中相邻的元素, 、P、S的电负性由大到小的顺序是
、P、S的电负性由大到小的顺序是(3)
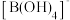 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为 中,
中, 与0之间不存在的化学键是
与0之间不存在的化学键是A.
 键 B.
键 B. 键 C.配位键 D.极性键
键 C.配位键 D.极性键(4)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是
(5)超高热导率半导体材料砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的原子坐标为
 ,若晶胞中
,若晶胞中 原子到B原子最近距离为
原子到B原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为 的计算式即可)。
的计算式即可)。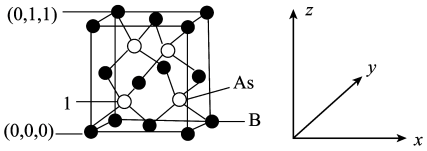
您最近一年使用:0次
2024-04-18更新
|
94次组卷
|
2卷引用:专题5 物质结构与性质 元素周期律-晶体结构与性质
3 . 有机合成中离不开各种催化剂的使用,开发各种针对性的、专用的催化剂一直是市场的迫切需求,如CuO-ZnO、 、
、 、Cu-cat-2500T等具备催化功能的高效催化剂产品。回答下列问题:
、Cu-cat-2500T等具备催化功能的高效催化剂产品。回答下列问题:
(1)基态铜原子的核外电子排布式为___________ 。
(2)催化剂 可专用于醛酮的加氢,如反应:
可专用于醛酮的加氢,如反应:___________ (填字母)。
a.极性共价键 b.非极性共价键 c.σ键 d.π键 e.氢键 f.配位键
②该反应涉及的所有元素中,电负性最大的元素为___________ (填元素符号,下同),第一电离能最小的是___________ 。
③反应物正丁醛的熔、沸点均比产物正丁醇的熔、沸点低,其主要原因是___________ 。
(3)在硫酸锌溶液中加入氨水,先生成沉淀,后沉淀溶解,生成四氨合锌离子。
① 的空间结构为
的空间结构为___________ ,其配体的中心原子的杂化轨道类型是___________ 。
②在 和
和 中两个N-H键之间的夹角,
中两个N-H键之间的夹角, 中的
中的___________ (填“更大”“更小”或“一样大”)。
(4)催化剂Cu-cat-2500T中Cu形成的晶胞如图所示,图中位于晶胞内的原子与位于晶胞面上的原子数之比为2:9,该晶胞参数分别为apm、2apm、2apm。设 为阿伏加德罗常数的值,则该晶胞中含
为阿伏加德罗常数的值,则该晶胞中含___________ 个Cu,由该晶胞形成的晶体的密度为___________  。
。
 、
、 、Cu-cat-2500T等具备催化功能的高效催化剂产品。回答下列问题:
、Cu-cat-2500T等具备催化功能的高效催化剂产品。回答下列问题:(1)基态铜原子的核外电子排布式为
(2)催化剂
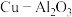 可专用于醛酮的加氢,如反应:
可专用于醛酮的加氢,如反应: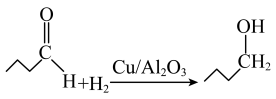
a.极性共价键 b.非极性共价键 c.σ键 d.π键 e.氢键 f.配位键
②该反应涉及的所有元素中,电负性最大的元素为
③反应物正丁醛的熔、沸点均比产物正丁醇的熔、沸点低,其主要原因是
(3)在硫酸锌溶液中加入氨水,先生成沉淀,后沉淀溶解,生成四氨合锌离子。
①
 的空间结构为
的空间结构为②在
 和
和 中两个N-H键之间的夹角,
中两个N-H键之间的夹角, 中的
中的(4)催化剂Cu-cat-2500T中Cu形成的晶胞如图所示,图中位于晶胞内的原子与位于晶胞面上的原子数之比为2:9,该晶胞参数分别为apm、2apm、2apm。设
 为阿伏加德罗常数的值,则该晶胞中含
为阿伏加德罗常数的值,则该晶胞中含 。
。
您最近一年使用:0次
2024-04-08更新
|
74次组卷
|
2卷引用:专题5 物质结构与性质 元素周期律-晶体结构与性质
解题方法
4 . 硫在古代被列为重要的药材,目前含硫化合物广泛用于医药、农药等。回答下列问题:
(1)硫离子的价电子排布图为___________ 。
(2)铁硫簇是普遍存在于生物体内的最古老的生命物质之一、一种铁硫原子簇的结构如图所示:___________ ,中心原子Fe的配位数为___________ 。
(3)解砷灵的结构简式为 。―SH和
。―SH和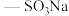 中硫原子的杂化轨道类型分别是
中硫原子的杂化轨道类型分别是___________ 、___________ ;1mol 中含
中含___________ mol 键。
键。
(4) 及
及 的分子结构及相应的键角如图所示。
的分子结构及相应的键角如图所示。 的键角小于
的键角小于 的原因是
的原因是___________ 。
(5) 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为___________ 。
(6)已知硫化锰(MnS)晶胞如图所示,该晶胞参数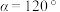 ,
, 。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别
。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别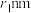 和
和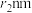 ,该晶体中原子的空间利用率为
,该晶体中原子的空间利用率为___________ (列出计算式即可)。
(1)硫离子的价电子排布图为
(2)铁硫簇是普遍存在于生物体内的最古老的生命物质之一、一种铁硫原子簇的结构如图所示:

(3)解砷灵的结构简式为
 。―SH和
。―SH和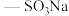 中硫原子的杂化轨道类型分别是
中硫原子的杂化轨道类型分别是 中含
中含 键。
键。(4)
 及
及 的分子结构及相应的键角如图所示。
的分子结构及相应的键角如图所示。
 的键角小于
的键角小于 的原因是
的原因是(5)
 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为(6)已知硫化锰(MnS)晶胞如图所示,该晶胞参数
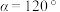 ,
, 。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别
。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别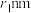 和
和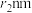 ,该晶体中原子的空间利用率为
,该晶体中原子的空间利用率为
您最近一年使用:0次
2024-04-04更新
|
305次组卷
|
2卷引用:专题5 物质结构与性质 元素周期律-晶体结构与性质
解题方法
5 .  的化合物在电化学和光电子器件中常作为氧化还原活性物种或空穴传输材料的掺杂剂。请根据所学知识回答下列问题。
的化合物在电化学和光电子器件中常作为氧化还原活性物种或空穴传输材料的掺杂剂。请根据所学知识回答下列问题。
I. 的某种配合物结构如图。
的某种配合物结构如图。 的价层电子轨道表示式为
的价层电子轨道表示式为____________ 。
(2)该配合物中 的配位数为
的配位数为____________ ,提供孤电子对的元素为____________ (填元素符号)。
(3)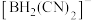 中H元素的化合价为
中H元素的化合价为____________ ,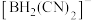 中心原子的杂化方式为
中心原子的杂化方式为___________ ,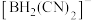 的立体构型为
的立体构型为__________ 形。
(4)该配合物中C、N、O、F四种元素的第一电离能由大到小的顺序为____________ 。
Ⅱ. 的某种氧化物
的某种氧化物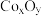 晶体为六方晶系,结构如图所示(○、
晶体为六方晶系,结构如图所示(○、 不表示大小,仅表示原子所在位置)。晶胞参数:底边为
不表示大小,仅表示原子所在位置)。晶胞参数:底边为 ,高为
,高为 ,
,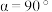 ,
,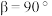 ,
,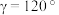 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。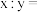
_______________ 。
(6)该晶体的密度为____________ (列出计算式即可) 。
。
 的化合物在电化学和光电子器件中常作为氧化还原活性物种或空穴传输材料的掺杂剂。请根据所学知识回答下列问题。
的化合物在电化学和光电子器件中常作为氧化还原活性物种或空穴传输材料的掺杂剂。请根据所学知识回答下列问题。I.
 的某种配合物结构如图。
的某种配合物结构如图。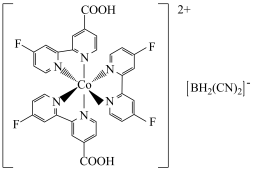
 的价层电子轨道表示式为
的价层电子轨道表示式为(2)该配合物中
 的配位数为
的配位数为(3)
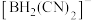 中H元素的化合价为
中H元素的化合价为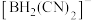 中心原子的杂化方式为
中心原子的杂化方式为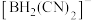 的立体构型为
的立体构型为(4)该配合物中C、N、O、F四种元素的第一电离能由大到小的顺序为
Ⅱ.
 的某种氧化物
的某种氧化物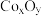 晶体为六方晶系,结构如图所示(○、
晶体为六方晶系,结构如图所示(○、 不表示大小,仅表示原子所在位置)。晶胞参数:底边为
不表示大小,仅表示原子所在位置)。晶胞参数:底边为 ,高为
,高为 ,
,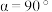 ,
,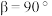 ,
,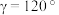 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
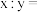
(6)该晶体的密度为
 。
。
您最近一年使用:0次
2024-03-26更新
|
247次组卷
|
7卷引用:专题5 物质结构与性质 元素周期律-晶体结构与性质
6 . N、P、As为第VA族元素,该族元素及其化合物在生产、生活中有广泛应用。回答下列问题:
(1)基态As原子核外有______ 个未成对电子,N、P、As电负性由大到小的顺序为______ 。
(2)已知:4AsH3 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为______ ,已知As4为正四面体结构,则1molAs4中含______ molσ键。
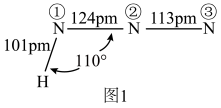
(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是______ 。叠氮酸的结构如图1所示,分子中②号N原子的杂化方式为_______ 。_______ ,该晶体的密度为______ g cm3。
cm3。
(1)基态As原子核外有
(2)已知:4AsH3
 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是
 cm3。
cm3。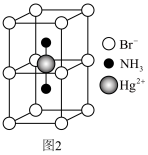
您最近一年使用:0次
2024-03-20更新
|
179次组卷
|
4卷引用:专题5 物质结构与性质 元素周期律-晶体结构与性质
解题方法
7 . 硼(B)是一种重要的类金属元素,在化工、冶金等行业具有重要的应用价值。请回答:
(1)基态B原子的核外电子排布式是___________ 。
(2)乙硼烷水解生成硼酸(H3BO3),常温常压下硼酸晶体结构为层状,其二维平面结构如图___________ 晶体(填“离子”或“分子”),电负性:B___________ O。(填“>”或“<”)
②1 mol H3BO3的晶体中含有___________ mol氢键,B原子的杂化方式为___________ 。
③硼酸是一元弱酸,它本身不给出质子,但是溶于水后能给出 。请解释硼酸水溶液呈酸性的原因(请用相关文字解释):
。请解释硼酸水溶液呈酸性的原因(请用相关文字解释):___________ 。
(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有___________ (填字母)。 键 e.
键 e. 键 f.氢键
键 f.氢键
(4)硼化钙晶胞结构如图所示,B原子构成 八面体,各个顶点通过
八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为 ,晶胞密度为
,晶胞密度为 。
。___________ 。
②晶胞边长为___________ nm(已知NA为阿伏加德罗常数)。
(1)基态B原子的核外电子排布式是
(2)乙硼烷水解生成硼酸(H3BO3),常温常压下硼酸晶体结构为层状,其二维平面结构如图
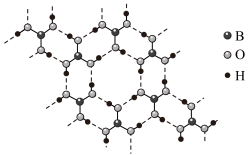
②1 mol H3BO3的晶体中含有
③硼酸是一元弱酸,它本身不给出质子,但是溶于水后能给出
 。请解释硼酸水溶液呈酸性的原因(请用相关文字解释):
。请解释硼酸水溶液呈酸性的原因(请用相关文字解释):(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有

 键 e.
键 e. 键 f.氢键
键 f.氢键(4)硼化钙晶胞结构如图所示,B原子构成
 八面体,各个顶点通过
八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为 ,晶胞密度为
,晶胞密度为 。
。
②晶胞边长为
您最近一年使用:0次
2024-03-10更新
|
270次组卷
|
2卷引用:专题5 物质结构与性质 元素周期律-晶体结构与性质
解题方法
8 . 蓝色晶体二草酸合铜(Ⅱ)酸钾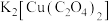 是一种常用化工原料。回答下列问题:
是一种常用化工原料。回答下列问题:
(1)对于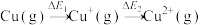 中的能量变化
中的能量变化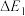
___________ (选填“>”、“<”) 。
。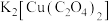 中四种元素电负性由大到小顺序为
中四种元素电负性由大到小顺序为___________ 。
(2) 分子结构为平面形状,如下图所示。其中
分子结构为平面形状,如下图所示。其中 和
和 键数目之比为
键数目之比为___________ 。a处氧原子的杂化轨道类型为___________ 。在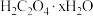 晶体中,每个草酸分子周围通过
晶体中,每个草酸分子周围通过___________ 作用与6个 分子相连,每个
分子相连,每个 分子则与3个草酸分子相连,则x=
分子则与3个草酸分子相连,则x=___________ 。 混合溶液可形成配合物
混合溶液可形成配合物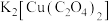 。这说明配位能力:草酸根
。这说明配位能力:草酸根___________ (选填“>”、“<”)乙酸根。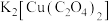 的晶体类型属于
的晶体类型属于___________ 。
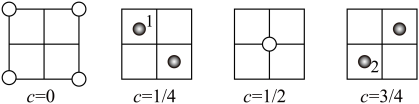
(4)一种 的氧化物属于立方晶系,其晶胞沿c轴不同位置的投影(ab平面)如下图,黑球为
的氧化物属于立方晶系,其晶胞沿c轴不同位置的投影(ab平面)如下图,黑球为 、灰球为
、灰球为 。该晶体化学式为
。该晶体化学式为___________ 。已知立方晶胞参数为ynm,则 与
与 之间距离为
之间距离为___________  。
。
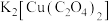 是一种常用化工原料。回答下列问题:
是一种常用化工原料。回答下列问题:(1)对于
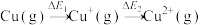 中的能量变化
中的能量变化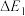
 。
。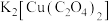 中四种元素电负性由大到小顺序为
中四种元素电负性由大到小顺序为(2)
 分子结构为平面形状,如下图所示。其中
分子结构为平面形状,如下图所示。其中 和
和 键数目之比为
键数目之比为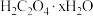 晶体中,每个草酸分子周围通过
晶体中,每个草酸分子周围通过 分子相连,每个
分子相连,每个 分子则与3个草酸分子相连,则x=
分子则与3个草酸分子相连,则x=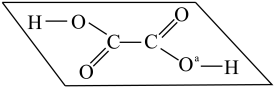
 混合溶液可形成配合物
混合溶液可形成配合物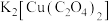 。这说明配位能力:草酸根
。这说明配位能力:草酸根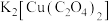 的晶体类型属于
的晶体类型属于(4)一种
 的氧化物属于立方晶系,其晶胞沿c轴不同位置的投影(ab平面)如下图,黑球为
的氧化物属于立方晶系,其晶胞沿c轴不同位置的投影(ab平面)如下图,黑球为 、灰球为
、灰球为 。该晶体化学式为
。该晶体化学式为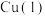 与
与 之间距离为
之间距离为 。
。
您最近一年使用:0次
2024-02-27更新
|
285次组卷
|
2卷引用:专题5 物质结构与性质 元素周期律-晶体结构与性质
名校
9 . 铀氮化合物是核燃料循环系统中的重要材料。已知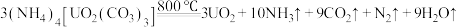 。回答下列问题:
。回答下列问题:
(1)基态氮原子价电子轨道表达式为___________ 。
(2)反应中断裂的化学键有___________ (填标号)。
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
(3)反应所得的气态产物中属于非极性分子的是___________ (填化学式,下同);氢化物中更易与 形成配离子的是
形成配离子的是___________ 。向 溶液中滴加少量氨水,反应现象为
溶液中滴加少量氨水,反应现象为___________ ,继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式___________ 。
(4)基态U原子的外围电子排布式为 ,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是___________(填标号)。
,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是___________(填标号)。
(5) 的空间构型为
的空间构型为___________ ,其结构中存在大 键,可表示为
键,可表示为___________ (用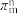 表示,m代表参与形成大
表示,m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数)。
键的电子数)。
(6)某种铀氮化物的晶胞如图。已知晶胞密度为 ,U原子半径为
,U原子半径为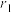 nm,N原子半径为
nm,N原子半径为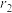 nm,设
nm,设 为阿伏加德罗常数的值,则该晶胞的空间利用率为
为阿伏加德罗常数的值,则该晶胞的空间利用率为___________ (含d、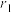 、
、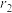 、
、 的计算表达式)。
的计算表达式)。
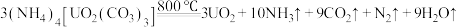 。回答下列问题:
。回答下列问题:(1)基态氮原子价电子轨道表达式为
(2)反应中断裂的化学键有
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
(3)反应所得的气态产物中属于非极性分子的是
 形成配离子的是
形成配离子的是 溶液中滴加少量氨水,反应现象为
溶液中滴加少量氨水,反应现象为(4)基态U原子的外围电子排布式为
 ,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是___________(填标号)。
,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是___________(填标号)。A. | B.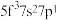 | C.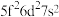 | D. |
(5)
 的空间构型为
的空间构型为 键,可表示为
键,可表示为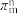 表示,m代表参与形成大
表示,m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数)。
键的电子数)。(6)某种铀氮化物的晶胞如图。已知晶胞密度为
 ,U原子半径为
,U原子半径为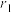 nm,N原子半径为
nm,N原子半径为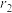 nm,设
nm,设 为阿伏加德罗常数的值,则该晶胞的空间利用率为
为阿伏加德罗常数的值,则该晶胞的空间利用率为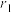 、
、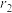 、
、 的计算表达式)。
的计算表达式)。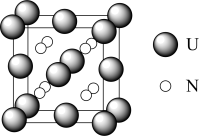
您最近一年使用:0次
2024-01-18更新
|
375次组卷
|
2卷引用:专题5 物质结构与性质 元素周期律-晶体结构与性质
解题方法
10 . 中科院大连化学物理研究所科学家用 、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《NatureEnergy》杂志上。
、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《NatureEnergy》杂志上。
(1)基态 的核外电子排布式为
的核外电子排布式为___________ ,若该离子核外电子空间运动状态有15种,则该离子处于___________ (填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸( )是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中 的空间构型为
的空间构型为___________ 。
②甘氨酸的晶体类型是___________ ,其分子中碳原子的杂化方式为___________ 。
(3)比较 分子(前者)和在
分子(前者)和在 中
中 (后者)分子中
(后者)分子中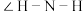 的键角大小,前者
的键角大小,前者___________ 后者(填“>”、“<”或“=”),原因是___________ 。1mol 中含有σ键的物质的量为
中含有σ键的物质的量为___________ mol。
(4)亚氨基锂(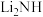 ,摩尔质量为Mg/mol),是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图所示,
,摩尔质量为Mg/mol),是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图所示, ,则阿伏加德罗常数
,则阿伏加德罗常数
___________ mol (列出表达式)。
(列出表达式)。
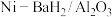 、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《NatureEnergy》杂志上。
、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《NatureEnergy》杂志上。(1)基态
 的核外电子排布式为
的核外电子排布式为(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(
 )是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。①硝酸溶液中
 的空间构型为
的空间构型为②甘氨酸的晶体类型是
(3)比较
 分子(前者)和在
分子(前者)和在 中
中 (后者)分子中
(后者)分子中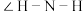 的键角大小,前者
的键角大小,前者 中含有σ键的物质的量为
中含有σ键的物质的量为(4)亚氨基锂(
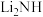 ,摩尔质量为Mg/mol),是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图所示,
,摩尔质量为Mg/mol),是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图所示,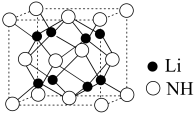
 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
2024-01-14更新
|
235次组卷
|
3卷引用:专题5 物质结构与性质 元素周期律-晶体结构与性质



