名校
解题方法
1 . 已知a、b、c、d、e、f是中学化学中常见的七种元素,其结构或者性质信息如下表所示:
(1)写出元素d基态原子的核外电子排布是_______ 。
(2)写出元素e基态原子的价电子轨道排布式_______ 。
(3)元素a的原子核外共有_______ 种不同运动状态的电子,有_______ 种不同能量的电子。
(4)c、f的气态氢化物的稳定性顺序为_______ (填化学式),请比较a、b、c的电负性大小顺序为_______ (填元素符号)。
(5)用电子式表示ac2的形成过程_______ ,在分子中 键与π键的比值关系
键与π键的比值关系_______ 。
(6)元素f位于周期表中_______ 区。
(7)氢元素与b元素形成的10电子分子的价层电子对数____ ,分子的空间构型为_____ 。
(8)元素e第二电离能为1958kJ/mol,元素d的第二电离能为1753kJ/mol,元素e的第二电离能大于元素d的第二电离能的原因是_______ 。
| 元素 | 结构或者性质信息 |
| a | 原子的L层上s能级电子数等于p能级电子数 |
| b | 非金属元素,其单质为气态,有多种氧化物且都是大气污染物 |
| c | 原子的最外层电子数是内层电子数的3倍 |
| d | 第四周期VIII族中原子序数最大的元素 |
| e | 元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
| f | 单质常温、常压下是易挥发的液体,基态原子的N层上有1个未成对的p电子 |
(2)写出元素e基态原子的价电子轨道排布式
(3)元素a的原子核外共有
(4)c、f的气态氢化物的稳定性顺序为
(5)用电子式表示ac2的形成过程
 键与π键的比值关系
键与π键的比值关系(6)元素f位于周期表中
(7)氢元素与b元素形成的10电子分子的价层电子对数
(8)元素e第二电离能为1958kJ/mol,元素d的第二电离能为1753kJ/mol,元素e的第二电离能大于元素d的第二电离能的原因是
您最近一年使用:0次
名校
解题方法
2 . 液氨是一种很好的溶剂,液氨可以微弱的电离产生NH 和NH
和NH 。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH
。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH 存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH
存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH 、NO
、NO 的说法正确的是
的说法正确的是
 和NH
和NH 。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH
。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH 存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH
存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH 、NO
、NO 的说法正确的是
的说法正确的是| A.NH2OH难溶于水 | B.NO 的空间构型为直线形 的空间构型为直线形 |
C.NH3的键角比NH 中的大 中的大 | D.[Cu(NH3)4]2+中提供孤电子对的原子是Cu |
您最近一年使用:0次
2022-05-30更新
|
779次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
3 . 锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:
(1)Mn的价电子排布式为___________ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“___________ 理论”解释。
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列___________ (填序号),每个Mn原子周围紧邻的原子数为___________ 。
A.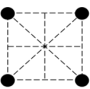 B.
B.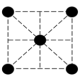 C.
C.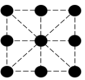 D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为___________ ,SO(CH3)2中键角∠C—S—O___________ CH3COCH3中键角∠C—C—O(填“大于”“小于”或“等于”),ClO 的空间构型是
的空间构型是___________ ,元素S、Cl、O的电负性由大到小的顺序为___________ 。
(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是___________ 。
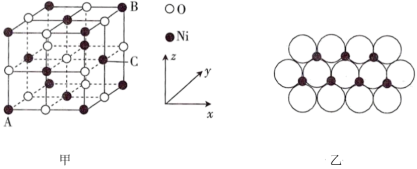
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为___________ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为___________ g(用含a、NA的代数式表示)。
(1)Mn的价电子排布式为
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列
A.
 B.
B. C.
C. D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为
 的空间构型是
的空间构型是(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为

您最近一年使用:0次
2021-12-23更新
|
1212次组卷
|
9卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高三上学期10月月考化学试题
黑龙江省哈尔滨师范大学附属中学2022-2023学年高三上学期10月月考化学试题黑龙江省绥化市绥棱县第一中学2022-2023学年高三上学期10月月考化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)四川省成都市成都外国语学校2022届高三下学期第二次诊断性考试理科综合化学试题广东省“六校联盟”2021-2022学年高三上学期第三次联考化学试题四川省南充高级中学2023-2024学年高三下学期第二次模拟考试化学四川省南充高级中学2024届高三第二次模拟考试理综-化学试题
名校
解题方法
4 . 根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子杂化方式及空间构型正确的是( )
| 选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
| A | H2O | sp | 直线形 | 直线形 |
| B | BBr3 | sp2 | 平面三角形 | 三角锥形 |
| C | PCl3 | sp2 | 四面体形 | 平面三角形 |
| D | CO32- | sp2 | 平面三角形 | 平面三角形 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-05-06更新
|
515次组卷
|
7卷引用:黑龙江省饶河县高级中学2021-2022学年上学期期末考试化学试题
黑龙江省饶河县高级中学2021-2022学年上学期期末考试化学试题新疆石河子第一中学2021-2022学年高二4月月考化学试题第2章 化学键与分子间作用力——B拓展区综合拓展(鲁科版选修3)甘肃省兰州市第一中学2019-2020学年高二下学期4月月考化学试题(已下线)第二单元 化学键与分子间作用力(能力提升卷)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)甘肃省兰州市第一中学2020-2021学年高二下学期4月月考化学试题(已下线)第4讲 空间构型



