名校
1 . 下列对物质性质及解释均正确的是
| 选项 | 性质 | 解释 |
| A | 熔点:Li<Na<K | K+的价电子数多,金属键最强 |
| B | 熔点:晶体硅<碳化硅 | 碳化硅中分子间作用力较大 |
| C | 酸性: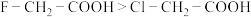 | 电负性:F>Cl,导致羧基中羟基的极性更大 |
| D | H2O的键角比H3O+的键角大 | 中心原子的孤电子对数目H2O>H3O+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024·黑龙江·模拟预测
解题方法
2 . CO2资源化利用受到越来越多的关注,它能有效减少碳排放,有效应对全球的气候变化,并且能充分利用碳资源。二氧化碳催化加氢制甲醇有利于减少温室气体排放,涉及的反应如下:
I.


II.
 kJ⋅mol-1
kJ⋅mol-1 
III.
 kJ⋅mol-1
kJ⋅mol-1 
回答下列问题:
(1)CO2分子的空间结构为___________ 形。
(2)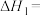
___________ kJ⋅mol-1。
(3)平衡常数
___________ (用 、
、 表示)。
表示)。
(4)为提高反应Ⅲ中 的平衡产率,应选择的反应条件为___________(填标号)。
的平衡产率,应选择的反应条件为___________(填标号)。
(5)不同压强下,按照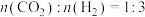 投料,发生反应I,实验测得
投料,发生反应I,实验测得 的平衡转化率随温度的变化关系如下图所示。
的平衡转化率随温度的变化关系如下图所示。 、
、 由大到小的顺序为
由大到小的顺序为___________ ,判断的依据是___________ 。
②图中A点对应的甲醇的体积分数是___________ %(计算结果保留1位小数)。
(6)在恒温恒压(压强为p)的某密闭容器中,充入1mol 和3mol
和3mol ,仅发生反应I和II,经过一段时间后,反应I和II达到平衡,此时测得
,仅发生反应I和II,经过一段时间后,反应I和II达到平衡,此时测得 的平衡转化率为20%,甲醇的选择性为50%{甲醇选择性[
的平衡转化率为20%,甲醇的选择性为50%{甲醇选择性[ ]},则该温度下反应I的平衡常数
]},则该温度下反应I的平衡常数
___________ (写出计算式即可,分压=总压×物质的量分数)。
I.



II.

 kJ⋅mol-1
kJ⋅mol-1 
III.

 kJ⋅mol-1
kJ⋅mol-1 
回答下列问题:
(1)CO2分子的空间结构为
(2)
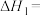
(3)平衡常数

 、
、 表示)。
表示)。(4)为提高反应Ⅲ中
 的平衡产率,应选择的反应条件为___________(填标号)。
的平衡产率,应选择的反应条件为___________(填标号)。| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
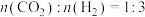 投料,发生反应I,实验测得
投料,发生反应I,实验测得 的平衡转化率随温度的变化关系如下图所示。
的平衡转化率随温度的变化关系如下图所示。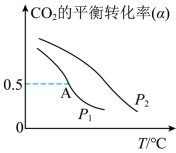
 、
、 由大到小的顺序为
由大到小的顺序为②图中A点对应的甲醇的体积分数是
(6)在恒温恒压(压强为p)的某密闭容器中,充入1mol
 和3mol
和3mol ,仅发生反应I和II,经过一段时间后,反应I和II达到平衡,此时测得
,仅发生反应I和II,经过一段时间后,反应I和II达到平衡,此时测得 的平衡转化率为20%,甲醇的选择性为50%{甲醇选择性[
的平衡转化率为20%,甲醇的选择性为50%{甲醇选择性[ ]},则该温度下反应I的平衡常数
]},则该温度下反应I的平衡常数
您最近一年使用:0次
名校
解题方法
3 .  (砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成
(砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成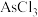 ,
,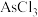 和
和 反应的产物之一为
反应的产物之一为 。下列说法错误的是
。下列说法错误的是
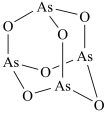
 (砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成
(砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成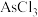 ,
,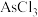 和
和 反应的产物之一为
反应的产物之一为 。下列说法错误的是
。下列说法错误的是
A. 分子中As原子的杂化方式为 分子中As原子的杂化方式为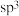 |
B.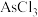 的分子空间构型为平面正三角形 的分子空间构型为平面正三角形 |
C. 的价层电子对互斥模型是四面体形 的价层电子对互斥模型是四面体形 |
D. 分子的键角小于 分子的键角小于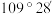 |
您最近一年使用:0次
2023-07-06更新
|
507次组卷
|
4卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题
名校
解题方法
4 . 现有A、B、C、D、E、F、G、H八种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
(1)C2A4的电子式为_______ 。
(2)B元素的原子核外共有_______ 种不同空间运动状态的电子,电子所处最高能级轨道的形状为_______ 。
(3)G2D分子的VSEPR模型名称为_______ 。
(4)某同学推断E元素基态原子的轨道表示式为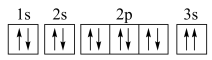 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了_______ ,解释E元素原子的第一电离能大于F元素原子的第一电离能的原因:_______ 。
(5)B2A4分子中含有的σ键、π键数目之比为_______ 。
(6)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:_______ 。
(7)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有_______ 种。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
(1)C2A4的电子式为
(2)B元素的原子核外共有
(3)G2D分子的VSEPR模型名称为
(4)某同学推断E元素基态原子的轨道表示式为
 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了(5)B2A4分子中含有的σ键、π键数目之比为
(6)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:
(7)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有
您最近一年使用:0次
名校
解题方法
5 . 已知a、b、c、d、e、f是中学化学中常见的七种元素,其结构或者性质信息如下表所示:
(1)写出元素d基态原子的核外电子排布是_______ 。
(2)写出元素e基态原子的价电子轨道排布式_______ 。
(3)元素a的原子核外共有_______ 种不同运动状态的电子,有_______ 种不同能量的电子。
(4)c、f的气态氢化物的稳定性顺序为_______ (填化学式),请比较a、b、c的电负性大小顺序为_______ (填元素符号)。
(5)用电子式表示ac2的形成过程_______ ,在分子中 键与π键的比值关系
键与π键的比值关系_______ 。
(6)元素f位于周期表中_______ 区。
(7)氢元素与b元素形成的10电子分子的价层电子对数____ ,分子的空间构型为_____ 。
(8)元素e第二电离能为1958kJ/mol,元素d的第二电离能为1753kJ/mol,元素e的第二电离能大于元素d的第二电离能的原因是_______ 。
| 元素 | 结构或者性质信息 |
| a | 原子的L层上s能级电子数等于p能级电子数 |
| b | 非金属元素,其单质为气态,有多种氧化物且都是大气污染物 |
| c | 原子的最外层电子数是内层电子数的3倍 |
| d | 第四周期VIII族中原子序数最大的元素 |
| e | 元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
| f | 单质常温、常压下是易挥发的液体,基态原子的N层上有1个未成对的p电子 |
(2)写出元素e基态原子的价电子轨道排布式
(3)元素a的原子核外共有
(4)c、f的气态氢化物的稳定性顺序为
(5)用电子式表示ac2的形成过程
 键与π键的比值关系
键与π键的比值关系(6)元素f位于周期表中
(7)氢元素与b元素形成的10电子分子的价层电子对数
(8)元素e第二电离能为1958kJ/mol,元素d的第二电离能为1753kJ/mol,元素e的第二电离能大于元素d的第二电离能的原因是
您最近一年使用:0次
名校
解题方法
6 . 从微粒结构角度分析,下列说法正确的是
A.I 的空间构型为V形,中心原子的杂化形式为sp3 的空间构型为V形,中心原子的杂化形式为sp3 |
| B.ZnCO3中,阴离子空间构型为平面三角形,C原子的杂化形式为sp3 |
| C.根据价层电子对互斥理论,H2S、SO2、SO3三种分子中,中心原子价电子对数相等 |
D.三氧化硫有单分子气体和三聚分子固体(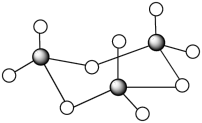 )两种存在形式,两种形式中S原子的杂化轨道类型相同 )两种存在形式,两种形式中S原子的杂化轨道类型相同 |
您最近一年使用:0次
2022-10-03更新
|
946次组卷
|
5卷引用:黑龙江省哈尔滨市第九中学2023-2024学年高二下学期开学考试化学试卷
名校
解题方法
7 . 下列粒子的空间构型不同于其他三个的是
A.气态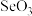 | B.气态 | C. | D. |
您最近一年使用:0次
2022-09-08更新
|
503次组卷
|
4卷引用:黑龙江省哈尔滨市第九中学2023-2024学年高二下学期开学考试化学试卷
名校
解题方法
8 . 液氨是一种很好的溶剂,液氨可以微弱的电离产生NH 和NH
和NH 。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH
。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH 存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH
存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH 、NO
、NO 的说法正确的是
的说法正确的是
 和NH
和NH 。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH
。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH 存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH
存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH 、NO
、NO 的说法正确的是
的说法正确的是| A.NH2OH难溶于水 | B.NO 的空间构型为直线形 的空间构型为直线形 |
C.NH3的键角比NH 中的大 中的大 | D.[Cu(NH3)4]2+中提供孤电子对的原子是Cu |
您最近一年使用:0次
2022-05-30更新
|
772次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
9 . 锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:
(1)Mn的价电子排布式为___________ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“___________ 理论”解释。
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列___________ (填序号),每个Mn原子周围紧邻的原子数为___________ 。
A.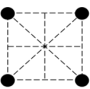 B.
B.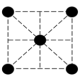 C.
C.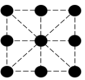 D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为___________ ,SO(CH3)2中键角∠C—S—O___________ CH3COCH3中键角∠C—C—O(填“大于”“小于”或“等于”),ClO 的空间构型是
的空间构型是___________ ,元素S、Cl、O的电负性由大到小的顺序为___________ 。
(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是___________ 。
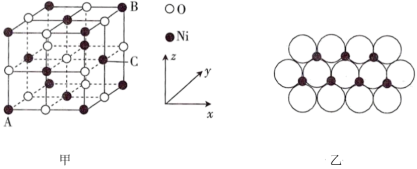
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为___________ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为___________ g(用含a、NA的代数式表示)。
(1)Mn的价电子排布式为
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列
A.
 B.
B. C.
C. D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为
 的空间构型是
的空间构型是(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为

您最近一年使用:0次
2021-12-23更新
|
1199次组卷
|
9卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高三上学期10月月考化学试题
黑龙江省哈尔滨师范大学附属中学2022-2023学年高三上学期10月月考化学试题黑龙江省绥化市绥棱县第一中学2022-2023学年高三上学期10月月考化学试题广东省“六校联盟”2021-2022学年高三上学期第三次联考化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)四川省成都市成都外国语学校2022届高三下学期第二次诊断性考试理科综合化学试题四川省南充高级中学2023-2024学年高三下学期第二次模拟考试化学四川省南充高级中学2024届高三第二次模拟考试理综-化学试题
解题方法
10 . 2020 年 2 月 15 日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(2019 − nCoV)的感染。
(1)已知磷酸氯喹的结构如图所示,则所含 C、N、O 三种元素第一电离能由大到小的顺序为_______ 。P 原子核外价层电子排布式为_______
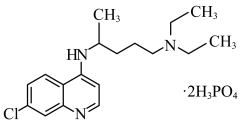
(2)磷酸氯喹中 N 原子的杂化方式为_______ ,NH3是一种极易溶于水的气体,其沸点比 AsH3的沸点高,其原因是_______ 。
(3)H3PO4中 PO 的空间构型为
的空间构型为_______ 。
(4)磷化镓是一种由ⅢA 族元素镓(Ga)与 VA 族元素磷(P)人工合成的Ⅲ—V 族化合物半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被 P 原子代替,顶点和面心的碳原子被 Ga 原子代替。
①磷化镓晶体中含有的化学键类型为_______ (填选项字母)
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
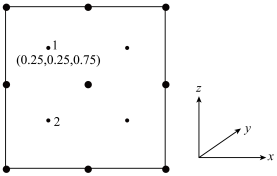
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿 y轴投影的晶胞中所有原子的分布图如图,则原子 2 的分数坐标为_______ 。
③若磷化镓的晶体密度为ρg·cm−3,阿伏加德罗常数的值为NA,则晶胞中 Ga 和 P 原子的最近距离为_______ pm。
(1)已知磷酸氯喹的结构如图所示,则所含 C、N、O 三种元素第一电离能由大到小的顺序为

(2)磷酸氯喹中 N 原子的杂化方式为
(3)H3PO4中 PO
 的空间构型为
的空间构型为(4)磷化镓是一种由ⅢA 族元素镓(Ga)与 VA 族元素磷(P)人工合成的Ⅲ—V 族化合物半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被 P 原子代替,顶点和面心的碳原子被 Ga 原子代替。
①磷化镓晶体中含有的化学键类型为
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿 y轴投影的晶胞中所有原子的分布图如图,则原子 2 的分数坐标为

③若磷化镓的晶体密度为ρg·cm−3,阿伏加德罗常数的值为NA,则晶胞中 Ga 和 P 原子的最近距离为
您最近一年使用:0次



