名校
解题方法
1 . 反应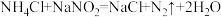 应用于石油开采。下列说法正确的是
应用于石油开采。下列说法正确的是
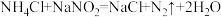 应用于石油开采。下列说法正确的是
应用于石油开采。下列说法正确的是A. 的电子式为 的电子式为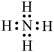 | B. 中 中 元素的化合价为+5 元素的化合价为+5 |
C.N2分子中存在 键 键 | D.H2O分子结构呈直线型 |
您最近一年使用:0次
解题方法
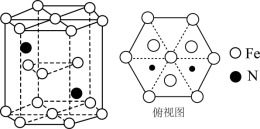
2 . 近日,科学家利用铁配合物催化氮气选择性转化成肼。铁配合物结构如图所示(Et为乙基:-CH2CH3)。

回答下列问题:
(1)基态 的价层电子排布式
的价层电子排布式___________ ,微粒半径Fe___________  。(填“大于”、“小于”或“等于”)
。(填“大于”、“小于”或“等于”)
(2) 所含元素中,电负性最大的元素是
所含元素中,电负性最大的元素是___________ 。P原子的杂化类型是___________ 。
(3) 和
和 的相对分子质量相同,但是常温常压下,
的相对分子质量相同,但是常温常压下, 呈液态,而
呈液态,而 呈气态,其主要原因是
呈气态,其主要原因是___________ 。
(4) 的VSEPR模型为
的VSEPR模型为___________ 。写出N2的一种等电子体___________ 。
(5)某种磁性氮化铁的晶胞结构如图所示。已知: 为阿伏加德罗常数的值,六棱柱底边的边长为
为阿伏加德罗常数的值,六棱柱底边的边长为 ,高为
,高为 ,该晶体中Fe、N原子个数最简比为
,该晶体中Fe、N原子个数最简比为___________ 。该晶体的密度为___________  (只列计算式)。
(只列计算式)。

回答下列问题:
(1)基态
 的价层电子排布式
的价层电子排布式 。(填“大于”、“小于”或“等于”)
。(填“大于”、“小于”或“等于”)(2)
 所含元素中,电负性最大的元素是
所含元素中,电负性最大的元素是(3)
 和
和 的相对分子质量相同,但是常温常压下,
的相对分子质量相同,但是常温常压下, 呈液态,而
呈液态,而 呈气态,其主要原因是
呈气态,其主要原因是(4)
 的VSEPR模型为
的VSEPR模型为(5)某种磁性氮化铁的晶胞结构如图所示。已知:
 为阿伏加德罗常数的值,六棱柱底边的边长为
为阿伏加德罗常数的值,六棱柱底边的边长为 ,高为
,高为 ,该晶体中Fe、N原子个数最简比为
,该晶体中Fe、N原子个数最简比为 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
3 . 下列各图中的大黑点代表原子序数从 号元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是
号元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是
 号元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是
号元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是| A | B | C | D |
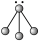 | 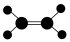 |  |  |
 |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 回答下列问题。
(1) 中,
中, 的轨道杂化方式为
的轨道杂化方式为___________ ;列举与 空间结构相同的一种离子和一种分子:
空间结构相同的一种离子和一种分子:___________ 、___________ (填化学式)。
(2)用价电子对互斥理论推断 分子中,
分子中, 原子的轨道杂化方式为
原子的轨道杂化方式为___________ , 分子中
分子中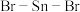 的键角
的键角___________  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(3)下列物质中具有旋光性的是___________(填标号)。
(1)
 中,
中, 的轨道杂化方式为
的轨道杂化方式为 空间结构相同的一种离子和一种分子:
空间结构相同的一种离子和一种分子:(2)用价电子对互斥理论推断
 分子中,
分子中, 原子的轨道杂化方式为
原子的轨道杂化方式为 分子中
分子中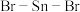 的键角
的键角 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。(3)下列物质中具有旋光性的是___________(填标号)。
A.乙醇( ) ) | B.1,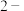 二氧丙烷( 二氧丙烷( ) ) |
C.乙酸( ) ) | D.乳酸(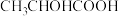 ) ) |
您最近一年使用:0次
名校
5 . H2S 和 SO2 反应生成 S 和 H2O。下列有关H2S、SO2、SO 、SO
、SO 的说法正确的是
的说法正确的是
 、SO
、SO 的说法正确的是
的说法正确的是| A.H2S 的沸点比H2O 的高 | B.SO2 与H2S 反应体现SO2 的还原性 |
C.SO 中S 原子轨道杂化类型为sp3 中S 原子轨道杂化类型为sp3 | D.SO 的空间构型为平面正方形 的空间构型为平面正方形 |
您最近一年使用:0次
真题
名校
6 . 下列化学用语或表述正确的是
| A.BeCl2的空间结构:V形 | B.P4中的共价键类型:非极性键 |
| C.基态Ni原子价电子排布式:3d10 | D.顺—2—丁烯的结构简式: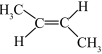 |
您最近一年使用:0次
2023-06-13更新
|
10102次组卷
|
12卷引用:吉林省吉林市第一中学2022-2023学年高一6月月考(线上)化学试题
吉林省吉林市第一中学2022-2023学年高一6月月考(线上)化学试题2023年高考辽宁卷化学真题(已下线)T2-化学用语(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)专题02 化学用语江西省乐安县第二中学2022-2023学年高二下学期6月期末考试化学试题(已下线)专题02 化学用语(已下线)专题02 化学用语(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题02 化学用语的正误判断-2023年高考化学真题题源解密(全国通用)(已下线)专题02 化学用语及其应用-2023年高考化学真题题源解密(新高考专用)(已下线)题型01 物质的组成与分类 传统文化 化学用语-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
7 . 从微粒结构角度分析,下列说法错误的是
| A.晶体和非晶体的本质差别是内部构成粒子在三维空间是否呈周期性有序排列 |
B. 中阴离子空间结构为平面三角形,C原子的杂化方式为 中阴离子空间结构为平面三角形,C原子的杂化方式为 |
C.根据价层电子对互斥模型, 、 、 、 、 的气态分子中, 的气态分子中, 的中心原子价层电子对数与其他分子不同 的中心原子价层电子对数与其他分子不同 |
D.三氧化硫有单分子气体和三聚分子固体( )两种存在形式,两种形式中S原子的杂化轨道类型相同 )两种存在形式,两种形式中S原子的杂化轨道类型相同 |
您最近一年使用:0次
名校
8 . 下列元素或化合物的性质变化顺序正确的是
A.第一电离能: |
| B.第四周期元素中,锰原子价电子层中未成对电子数最多 |
C.价层电子对互斥模型中, 键电子对数计入中心原子的价层电子对数 键电子对数计入中心原子的价层电子对数 |
D.共价键的极性: |
您最近一年使用:0次
名校
9 . 下列分子或离子中,价层电子对互斥模型与分子或离子的几何构型不一致的是
A. | B. | C. | D. |
您最近一年使用:0次
解题方法
10 . Ⅰ.硒化物(如KCu4Se8)可用于太阳能电池、光传感器、热电发电与制冷等。回答下列问题:
(1)K与Cu位于同周期,金属钾的熔点比铜的低,这是因为_____ 。
(2)O、S、Se均位于元素周期表第ⅥA族,它们的氢化物H2O、H2S及H2Se分子的键角从大到小顺序为_____ 。
(3)配合物[Cu(CH3CN)4]BF4中,阴离子的空间构型为_____ ,配合离子中与Cu(Ⅱ)形成配位键的原子是_____ ,配体中碳原子的杂化方式是_____ 。
(4)TMTSF( )中共价键的类型是
)中共价键的类型是_____ 。
Ⅱ.A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(5)四种元素中电负性最大的是_____ (填元素符号),其中C原子的核外电子排布式为_____ 。
(6)单质A有两种同素异形体,其中沸点高的是_____ (填分子式),原因是_____ 。
(7)C和D反应可生成组成比为1:3的化合物E,E的立体构型为______ ,中心原子的杂化轨道类型为_____ 。
(8)化合物D2A的立体构型为_____ ,中心原子的价层电子对数为_____ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____ 。
(1)K与Cu位于同周期,金属钾的熔点比铜的低,这是因为
(2)O、S、Se均位于元素周期表第ⅥA族,它们的氢化物H2O、H2S及H2Se分子的键角从大到小顺序为
(3)配合物[Cu(CH3CN)4]BF4中,阴离子的空间构型为
(4)TMTSF(
 )中共价键的类型是
)中共价键的类型是Ⅱ.A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(5)四种元素中电负性最大的是
(6)单质A有两种同素异形体,其中沸点高的是
(7)C和D反应可生成组成比为1:3的化合物E,E的立体构型为
(8)化合物D2A的立体构型为
您最近一年使用:0次



