解题方法
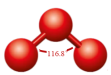
1 . 已知臭氧分子是由一个中心氧原子和两个端位氧原子构成的角形分子(如图),中心氧原子采用sp2杂化。
2.中心原子采取sp2杂化的分子,其VSEPR模型的键角理论值为120°,但O3分子的键角仅为116.8°,键角变小是因为___________ 。
| A.H2O | B.Cl2O | C.CO2 | D.SO2 |
您最近一年使用:0次
名校
解题方法
2 . 请回答下列问题。
(1)染发剂中普遍含有对苯二胺(其化学式为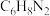 )会使易过敏的人引起发痒、水肿、气喘、胃炎和贫血等症状,另外它还具有致癌作用。因此:慎用染发剂,少染发为好。一个对苯二胺分子中碳氢氮原子最简个数比
)会使易过敏的人引起发痒、水肿、气喘、胃炎和贫血等症状,另外它还具有致癌作用。因此:慎用染发剂,少染发为好。一个对苯二胺分子中碳氢氮原子最简个数比_______ 。
(2)请判断下列物质之间的关系:A.同系物,B.同分异构体。2-甲基丁烷和丁烷_______ ;(填“A”或者“B”)异戊烷和2,2-二甲基丙烷_______ ;(填“A”或者“B”)
(3)单烯烃通式:(链状烯烃只含有一个碳碳双键),其通式为_______ 。
(4)请写出异丁烷的结构简式_______
(5)(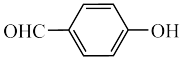 )和(
)和(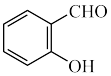 )两种有机物是同分异构体,已知易形成分子间氢键的物质沸点更高,则沸点更低芳香族化合物的命名为
)两种有机物是同分异构体,已知易形成分子间氢键的物质沸点更高,则沸点更低芳香族化合物的命名为_______ 。
(6)① 、②
、② 、③
、③ 三种分子中,键角由大到小的顺序
三种分子中,键角由大到小的顺序_______ 。
(7)苯丙氨酸(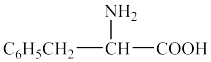 )有多种同分异构体,其中同时符合条件:①有带两个取代基的苯环②有一个硝基直接连接在苯环上的同分异构体有
)有多种同分异构体,其中同时符合条件:①有带两个取代基的苯环②有一个硝基直接连接在苯环上的同分异构体有_______ 种(不考虑立体异构)。
(1)染发剂中普遍含有对苯二胺(其化学式为
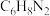 )会使易过敏的人引起发痒、水肿、气喘、胃炎和贫血等症状,另外它还具有致癌作用。因此:慎用染发剂,少染发为好。一个对苯二胺分子中碳氢氮原子最简个数比
)会使易过敏的人引起发痒、水肿、气喘、胃炎和贫血等症状,另外它还具有致癌作用。因此:慎用染发剂,少染发为好。一个对苯二胺分子中碳氢氮原子最简个数比(2)请判断下列物质之间的关系:A.同系物,B.同分异构体。2-甲基丁烷和丁烷
(3)单烯烃通式:(链状烯烃只含有一个碳碳双键),其通式为
(4)请写出异丁烷的结构简式
(5)(
 )和(
)和( )两种有机物是同分异构体,已知易形成分子间氢键的物质沸点更高,则沸点更低芳香族化合物的命名为
)两种有机物是同分异构体,已知易形成分子间氢键的物质沸点更高,则沸点更低芳香族化合物的命名为(6)①
 、②
、② 、③
、③ 三种分子中,键角由大到小的顺序
三种分子中,键角由大到小的顺序(7)苯丙氨酸(
 )有多种同分异构体,其中同时符合条件:①有带两个取代基的苯环②有一个硝基直接连接在苯环上的同分异构体有
)有多种同分异构体,其中同时符合条件:①有带两个取代基的苯环②有一个硝基直接连接在苯环上的同分异构体有
您最近一年使用:0次
名校
3 . 完成下列小题
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间结构是___________ ,中心原子的杂化方式为___________ 。
(2)根据价层电子对互斥模型,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___________ 。
(3)ZnCO3中,阴离子空间结构为___________ ,C原子的杂化方式为___________ 。
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间结构是
(2)根据价层电子对互斥模型,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(3)ZnCO3中,阴离子空间结构为
您最近一年使用:0次
名校
4 . 磷、氮和硫的相关化合物在药物化学及农业化学领域应用广泛。回答下列问题:
(1) 分子空间结构为
分子空间结构为___________ , 与
与 反应生成
反应生成 ,
, 结构为
结构为 ,
, 是
是___________ (填“极性”或“非极性”)分子。
(2)氯吡苯脲是一种常用的膨大剂,其结构简式为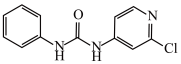 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。
①氯吡苯脲分子___________ (填“是”或“不是”)手性分子。
②氯吡苯脲分子中存在的作用力包括___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D. 键 E.配位键
键 E.配位键
(3)胆矾 可写成
可写成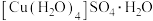 ,其结构示意图如下:
,其结构示意图如下:___________ 。
②已知 与
与 的空间结构相同,但
的空间结构相同,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是___________ 。
(1)
 分子空间结构为
分子空间结构为 与
与 反应生成
反应生成 ,
, 结构为
结构为 ,
, 是
是(2)氯吡苯脲是一种常用的膨大剂,其结构简式为
 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。①氯吡苯脲分子
②氯吡苯脲分子中存在的作用力包括
A.离子键 B.极性键 C.非极性键 D.
 键 E.配位键
键 E.配位键(3)胆矾
 可写成
可写成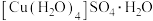 ,其结构示意图如下:
,其结构示意图如下: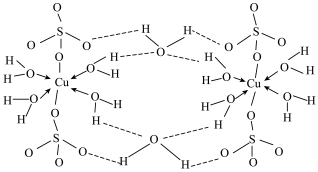
②已知
 与
与 的空间结构相同,但
的空间结构相同,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是
您最近一年使用:0次
2023-03-20更新
|
334次组卷
|
2卷引用:江西省南昌市第十九中学2022-2023学年高二下学期期中考试化学试卷
5 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)B的基态原子中能量最高的电子,其电子云在空间有___ 个方向,原子轨道呈____ 形。
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为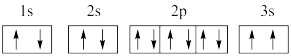 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_____________________ 。
(3)G位于______ 族______ 区。
(4)检验F元素的实验方法是_________________ 。
(5)BA3中心原子杂化轨道类型为___________ ;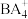 VSEPR模型为
VSEPR模型为___________ ;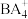 空间结构为
空间结构为_______________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1个 |
| C元素原子的第一至第四电离能分别是: I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)B的基态原子中能量最高的电子,其电子云在空间有
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(3)G位于
(4)检验F元素的实验方法是
(5)BA3中心原子杂化轨道类型为
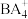 VSEPR模型为
VSEPR模型为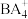 空间结构为
空间结构为
您最近一年使用:0次
6 . 请用符号“>”“<”“=”填空:
(1)酸性:醋酸(CH3COOH)____ 丙酸(CH3CH2COOH)。
(2)键角:NH3____ SiH4。
(3)第一电离能:P____ S。
(4)电负性:S____ P。
(5)半径:Na+____ Al3+。
(1)酸性:醋酸(CH3COOH)
(2)键角:NH3
(3)第一电离能:P
(4)电负性:S
(5)半径:Na+
您最近一年使用:0次
名校
解题方法
7 . 根据要求完成下列问题。
(1)下列数据,前者小于后者的是_______ (填序号)。
①键长:N—N和 ②键能:
②键能: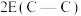 和
和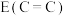
③键角: 和
和 ④键的极性:C—H和N—H
④键的极性:C—H和N—H
⑤沸点:邻羟基苯甲酸和对羟基苯甲酸 ⑥沸点: 和CO
和CO
(2)完成下表中的空白:
(1)下列数据,前者小于后者的是
①键长:N—N和
 ②键能:
②键能: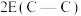 和
和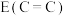
③键角:
 和
和 ④键的极性:C—H和N—H
④键的极性:C—H和N—H⑤沸点:邻羟基苯甲酸和对羟基苯甲酸 ⑥沸点:
 和CO
和CO(2)完成下表中的空白:
| 粒子 | VSEPR模型名称 | 分子(或离子)的空间结构 | 中心原子杂化轨道类型 |
| HCN | |||
 | |||
 |
您最近一年使用:0次
解题方法
8 . 根据物质结构的基本理论,原子之间通过原子轨道的重叠方式,以不同类型的化学键结合,形成具有不同空间结构的分子或离子,按照已学的物质结构知识填写下列空白。
(1)在 分子中,硼原子的杂化轨道类型为
分子中,硼原子的杂化轨道类型为_______ ,F-B-F的键角是_______ , 为
为_______ 分子(极性分子或非极性分子)。
(2) 可与
可与 形成
形成 ,
, 中氧原子采用
中氧原子采用_______ 杂化。 的立体构型为
的立体构型为_______ 。
(3) 中H-O-H键角比
中H-O-H键角比 中H-O-H键角大,原因为
中H-O-H键角大,原因为_______ 。
(1)在
 分子中,硼原子的杂化轨道类型为
分子中,硼原子的杂化轨道类型为 为
为(2)
 可与
可与 形成
形成 ,
, 中氧原子采用
中氧原子采用 的立体构型为
的立体构型为(3)
 中H-O-H键角比
中H-O-H键角比 中H-O-H键角大,原因为
中H-O-H键角大,原因为
您最近一年使用:0次
解题方法
9 . 叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N3-。试回答下列问题:
(1)下列有关说法正确的是___ (填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.HNO2是强酸
(2)叠氮酸根(N3-)能与许多金属离子等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显___ 价,配位数是___ 。
(5)根据价层电子对互斥理论判断N3-的空间构型为___ 。与N3-互为等电子体的分子有___ (写一种即可)。
(1)下列有关说法正确的是
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.HNO2是强酸
(2)叠氮酸根(N3-)能与许多金属离子等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显
(5)根据价层电子对互斥理论判断N3-的空间构型为
您最近一年使用:0次
名校
解题方法
10 . 试用VSEPR理论判断:_____________
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的形状 |
| SO3 | |||
| PO43- | |||
| NCl3 | |||
| CS2 |
您最近一年使用:0次



