1 . 现有四种短周期元素A、B、C、D。已知:①C、D位于同一周期,A、B位于同一主族;②四种元素可以组成化合物 、
、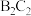 、
、 、
、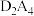 等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④
等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④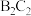 与
与 或
或 反应均能生成气体
反应均能生成气体 ,B的单质与
,B的单质与 反应可生成气体
反应可生成气体 ,气体
,气体 与气体
与气体 混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
(1)写出下列元素的符号:A_______ 、B_______ 、C_______ 、D_______ 。
(2)在化合物 、
、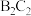 、
、 和
和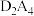 中,既含有离子键又含有非极性共价键的化合物的电子式为
中,既含有离子键又含有非极性共价键的化合物的电子式为_______ ,按原子轨道重叠方式,其非极性键的类型是_______ σ键;化合物分子中键角为180°的是_______ (填化学式),其结构式是_______ 。
(3) 分子的空间结构是
分子的空间结构是_______ 形,其键角_______ (填“>”“<”或“=”)180°;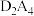 是平面形分子,其分子中含有
是平面形分子,其分子中含有_______ 个σ键,_______ 个π键。
 、
、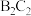 、
、 、
、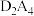 等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④
等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④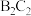 与
与 或
或 反应均能生成气体
反应均能生成气体 ,B的单质与
,B的单质与 反应可生成气体
反应可生成气体 ,气体
,气体 与气体
与气体 混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:(1)写出下列元素的符号:A
(2)在化合物
 、
、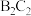 、
、 和
和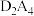 中,既含有离子键又含有非极性共价键的化合物的电子式为
中,既含有离子键又含有非极性共价键的化合物的电子式为(3)
 分子的空间结构是
分子的空间结构是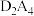 是平面形分子,其分子中含有
是平面形分子,其分子中含有
您最近一年使用:0次
名校
解题方法
2 . 柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂,医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:
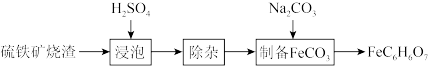
已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
(1)“浸泡”时加入过量硫酸的目的:___________ 。
(2)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由___________ 。
途径一:
途径二: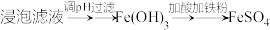
(3)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如下图:
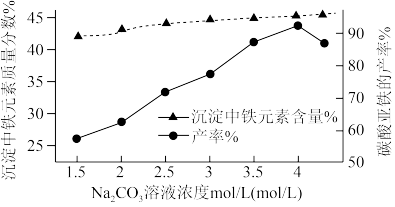
Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是:___________ 。
(4)在水溶液里,铁氰化钾K3[Fe(CN)6]与FeSO4生成蓝色沉淀,常用于Fe2+的检验。
①HCN分子、SO 离子的空间构型分别为
离子的空间构型分别为___________ 、___________ 。
②基态Fe3+的价电子排布图为___________ 。
③组成K3[Fe(CN)6]的各元素电负性由大到小的次序是___________ 。
④1mol铁氰化钾中σ键的数目为___________ mol。
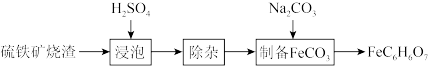
已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
| 金属离子 | 沉淀开始pH | 沉淀完全pH |
| Al3+ | 3.1 | 5.1 |
| Fe2+ | 5.9 | 6.9 |
| Fe3+ | 1.2 | 3.2 |
(2)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由
途径一:

途径二:
(3)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如下图:

Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是:
(4)在水溶液里,铁氰化钾K3[Fe(CN)6]与FeSO4生成蓝色沉淀,常用于Fe2+的检验。
①HCN分子、SO
 离子的空间构型分别为
离子的空间构型分别为②基态Fe3+的价电子排布图为
③组成K3[Fe(CN)6]的各元素电负性由大到小的次序是
④1mol铁氰化钾中σ键的数目为
您最近一年使用:0次
名校
解题方法
3 . 锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:
(1)Mn的价电子排布式为___________ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“___________ 理论”解释。
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列___________ (填序号),每个Mn原子周围紧邻的原子数为___________ 。
A.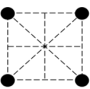 B.
B.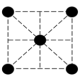 C.
C.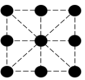 D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为___________ ,SO(CH3)2中键角∠C—S—O___________ CH3COCH3中键角∠C—C—O(填“大于”“小于”或“等于”),ClO 的空间构型是
的空间构型是___________ ,元素S、Cl、O的电负性由大到小的顺序为___________ 。
(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是___________ 。
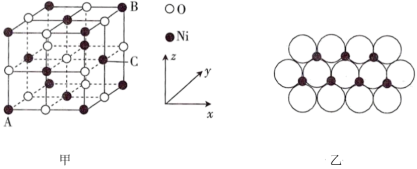
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为___________ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为___________ g(用含a、NA的代数式表示)。
(1)Mn的价电子排布式为
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列
A.
 B.
B. C.
C. D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为
 的空间构型是
的空间构型是(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为

您最近一年使用:0次
2021-12-23更新
|
1212次组卷
|
9卷引用:广东省“六校联盟”2021-2022学年高三上学期第三次联考化学试题
广东省“六校联盟”2021-2022学年高三上学期第三次联考化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三上学期10月月考化学试题黑龙江省绥化市绥棱县第一中学2022-2023学年高三上学期10月月考化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)四川省成都市成都外国语学校2022届高三下学期第二次诊断性考试理科综合化学试题四川省南充高级中学2023-2024学年高三下学期第二次模拟考试化学四川省南充高级中学2024届高三第二次模拟考试理综-化学试题
解题方法
4 . 在工业上用磷化铜(Cu3P2)制造磷青铜,磷青铜是含少量钪、锡、磷的铜合金,主要用作耐磨零件和弹性合金原件。
(1)基态Sc原子的价电子排布式为_______ ;同周期中未成对电子数与Sc相同的元素有_______ 种。
(2)磷青铜中的锡、磷两种元素电负性的大小为Sn_______ P(填“>”“<”或“=”)。
(3)NH3易与Cu2+形成[Cu(NH3)4]2+配离子,在该配离子中H-N-H键角比NH3分子中H-N-H键角大的原因是_______ 。[Cu(NH3)4]2+中2个NH3被2个H2O取代,得到两种结构的配离子,则[Cu(NH3)4]2+的空间构型是_______ (填“正四面体”或“正四边形”)。
(4)某立方磷青铜晶体的晶胞结构如图所示。

①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为_______ 。
②若晶体密度为ρg/cm3,最近的Cu原子核间距为_______ pm(用含ρ、NA的代数式表示)。
(1)基态Sc原子的价电子排布式为
(2)磷青铜中的锡、磷两种元素电负性的大小为Sn
(3)NH3易与Cu2+形成[Cu(NH3)4]2+配离子,在该配离子中H-N-H键角比NH3分子中H-N-H键角大的原因是
(4)某立方磷青铜晶体的晶胞结构如图所示。

①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为
②若晶体密度为ρg/cm3,最近的Cu原子核间距为
您最近一年使用:0次
2021-12-16更新
|
303次组卷
|
3卷引用:山东省潍坊市2021-2022学年高三上学期12月月考化学试题
山东省潍坊市2021-2022学年高三上学期12月月考化学试题湖北省十堰市普通高中六校联合体2022-2023高二下学期5月月考化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
名校
解题方法
5 . 铜是人类广泛使用的第一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态 原子最高能层的电子排布式为
原子最高能层的电子排布式为___________ 。
(2) 稀溶液中存在
稀溶液中存在 。已知d轨道也可以参与杂化,则
。已知d轨道也可以参与杂化,则 中
中 的杂化方式为___________(填选项字母)。
的杂化方式为___________(填选项字母)。
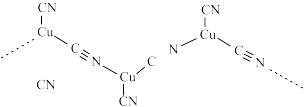
(3) 与
与 形成长链结构的阴离子如图所示,该阴离子中
形成长链结构的阴离子如图所示,该阴离子中 键与
键与 键数目之比为
键数目之比为___________ 。
(4)铜能与拟卤素 反应。拟卤素
反应。拟卤素 对应的酸有两种,理论上异硫氰酸
对应的酸有两种,理论上异硫氰酸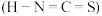 的沸点高于硫氰酸
的沸点高于硫氰酸 ,其原因为
,其原因为___________ ;写出一种与 互为等电子体的分子式
互为等电子体的分子式___________ 。
(5) 可形成
可形成 ,其中
,其中 代表
代表 。
。
①该化合物分子中, 模型为四面体或正四面体的非金属原子共有
模型为四面体或正四面体的非金属原子共有___________ 个。
② 的电负性由大到小的顺序为
的电负性由大到小的顺序为___________ 。
(6)一种由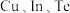 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
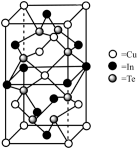
① 的配位数为
的配位数为___________ ;晶体中 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为___________ 。
②若晶胞底边的边长均为 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,设晶体的最简式的式量为
,设晶体的最简式的式量为 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态
 原子最高能层的电子排布式为
原子最高能层的电子排布式为(2)
 稀溶液中存在
稀溶液中存在 。已知d轨道也可以参与杂化,则
。已知d轨道也可以参与杂化,则 中
中 的杂化方式为___________(填选项字母)。
的杂化方式为___________(填选项字母)。A. | B. | C. | D. |
 与
与 形成长链结构的阴离子如图所示,该阴离子中
形成长链结构的阴离子如图所示,该阴离子中 键与
键与 键数目之比为
键数目之比为
(4)铜能与拟卤素
 反应。拟卤素
反应。拟卤素 对应的酸有两种,理论上异硫氰酸
对应的酸有两种,理论上异硫氰酸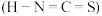 的沸点高于硫氰酸
的沸点高于硫氰酸 ,其原因为
,其原因为 互为等电子体的分子式
互为等电子体的分子式(5)
 可形成
可形成 ,其中
,其中 代表
代表 。
。①该化合物分子中,
 模型为四面体或正四面体的非金属原子共有
模型为四面体或正四面体的非金属原子共有②
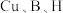 的电负性由大到小的顺序为
的电负性由大到小的顺序为(6)一种由
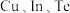 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
①
 的配位数为
的配位数为 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为②若晶胞底边的边长均为
 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,设晶体的最简式的式量为
,设晶体的最简式的式量为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2021-12-03更新
|
1003次组卷
|
5卷引用:河北省石家庄市2022届高三上学期教学质量检测(一)化学试题
河北省石家庄市2022届高三上学期教学质量检测(一)化学试题河北省石家庄市2021-2022学年高三上学期毕业班教学质量检测(一)化学试题广东省佛山市李兆基中学、郑裕彤中学两校2021-2022学年高三下学期3月联考化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】20(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
名校
6 . 氮族元素包括氮、磷、砷、锑、铋,它们的单质及其化合物在生产生活中具有十分重要的应用。回答下列问题:
(1)As元素原子核外电子占据的最高能层的符号是___ 。Bi3+的价层电子排布式为__ 。
(2)NH3、PH3、AsH3分子的键角大小顺序为__ 。HNO3的酸性强于HNO2的原因是__ 。
(3)我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl。其中N 为平面五边形结构,N的杂化方式为
为平面五边形结构,N的杂化方式为__ ,N 离子中含有的大
离子中含有的大 键表示为
键表示为__ ,该盐中所含元素的电负性大小顺序为____ ,H3O+的空间构型是___ 。
(4)氨硼烷(NH3BH3)是种具有潜力的固体储氢材料,分子中接受电子对的原子是___ 。与氨硼烷互为等电子体的分子是的___ (写名称),其熔点比(NH3BH3低,原因是___ 。
(5)PCl5固体是离子化合物,是由PCl 和PCl
和PCl 组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为
组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为___ g•cm-3(写出数学表达式)。
(1)As元素原子核外电子占据的最高能层的符号是
(2)NH3、PH3、AsH3分子的键角大小顺序为
(3)我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl。其中N
 为平面五边形结构,N的杂化方式为
为平面五边形结构,N的杂化方式为 离子中含有的大
离子中含有的大 键表示为
键表示为(4)氨硼烷(NH3BH3)是种具有潜力的固体储氢材料,分子中接受电子对的原子是
(5)PCl5固体是离子化合物,是由PCl
 和PCl
和PCl 组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为
组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为
您最近一年使用:0次
7 . 铜是人类最早发现并广泛使用的一种金属。黄铜矿是主要的炼铜原料, 是其中铜的主要存在形式。回答下列问题:
是其中铜的主要存在形式。回答下列问题:
(1)铜的价电子排布式为___________ ;
(2)稳定性:
___________  (填“<”“=”或“>”);并解释有关原因
(填“<”“=”或“>”);并解释有关原因___________ 。
(3) 中三种元素的电负性由大到小的顺序
中三种元素的电负性由大到小的顺序___________ (用元素符号表示)。
(4)在较低温度条件下, 与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为
与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为___________ ;X分子的立体构型为___________ 。
(5) 与浓硫酸反应可以得到硫酸铜,有关化学方程式为
与浓硫酸反应可以得到硫酸铜,有关化学方程式为___________ 。
(6)硫酸铜( )中阴离子的中心原子的杂化类型为
)中阴离子的中心原子的杂化类型为___________ 。
 是其中铜的主要存在形式。回答下列问题:
是其中铜的主要存在形式。回答下列问题:(1)铜的价电子排布式为
(2)稳定性:

 (填“<”“=”或“>”);并解释有关原因
(填“<”“=”或“>”);并解释有关原因(3)
 中三种元素的电负性由大到小的顺序
中三种元素的电负性由大到小的顺序(4)在较低温度条件下,
 与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为
与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为(5)
 与浓硫酸反应可以得到硫酸铜,有关化学方程式为
与浓硫酸反应可以得到硫酸铜,有关化学方程式为(6)硫酸铜(
 )中阴离子的中心原子的杂化类型为
)中阴离子的中心原子的杂化类型为
您最近一年使用:0次
2021-10-25更新
|
95次组卷
|
2卷引用:海南省华中师范大学琼中附属中学2022届高三第二次月考化学试题
解题方法
8 . ⅣA族元素及其化合物在材料等方面有重要用途,碳在自然界中存在多种同素异形体,硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)碳的一种单质的晶胞结构如图(a)所示。该单质的晶体类型为___ ,原子间存在的共价键类型为___ (填“σ键”、“π键”),碳原子杂化方式为___ 。

(2)基态Ge原子的核外电子排布式为[Ar]___ ,有___ 个未成对电子。
(3)硅和卤素单质反应可以得到SiX4,SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
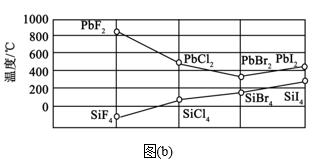
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是___ (填化学式),沸点依次升高的原因是___ ,气态分子SiX4的空间构型是__ 。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I的次序,PbX2中的化学键的离子性__ 、共价性__ 。(填“增强”“不变”或“减弱”)
(4)立方氮化硼的结构与图(a)相似,已知晶胞边长为361.5pm,则立方氮化硼的密度是___ g·cm-3。(只要求列算式,不必计算出数值,阿伏加德罗常数用NA表示)
(1)碳的一种单质的晶胞结构如图(a)所示。该单质的晶体类型为

(2)基态Ge原子的核外电子排布式为[Ar]
(3)硅和卤素单质反应可以得到SiX4,SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。

①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I的次序,PbX2中的化学键的离子性
(4)立方氮化硼的结构与图(a)相似,已知晶胞边长为361.5pm,则立方氮化硼的密度是
您最近一年使用:0次
名校
解题方法
9 . 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
(1)基态B原子的电子排布式为_______ ;B和N相比,电负性较大的是_______ ,BN中B元素的化合价为_______ ;
(2)在BF3分子中,F-B-F的键角是_______ ,B原子的杂化轨道类型为_______ ,BF3和过量NaF作用可生成NaBF4,BF 的立体结构为
的立体结构为_______ ;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为_______ ,层间作用力为_______ ;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是_______ g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。

(1)基态B原子的电子排布式为
(2)在BF3分子中,F-B-F的键角是
 的立体结构为
的立体结构为(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是
您最近一年使用:0次
解题方法
10 . 蛋白质是构成生物体的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为_______ (用元素符号表示)。
(2)NH3的空间结构是_______ 形
(3)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为____ ; 中的硫原子杂化方式为
中的硫原子杂化方式为____ ;
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:
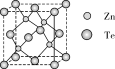
与Te原子距离最近的Te原子有_______ 个;若晶胞边长为apm,则晶体密度为_______ g/cm3(用含NA的式子表示,已知相对质量:Zn-65、Te-128)。
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为
(2)NH3的空间结构是
(3)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为
 中的硫原子杂化方式为
中的硫原子杂化方式为(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:

与Te原子距离最近的Te原子有
您最近一年使用:0次



