名校
解题方法
1 . 根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:___________ ,某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是 ,该元素的名称是
,该元素的名称是___________ 。
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型: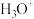
___________ ,
___________ 。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关反应的离子方程式___________ 、___________ 。
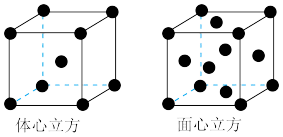
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为___________ ;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为___________ 。
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:
 ,该元素的名称是
,该元素的名称是(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:
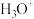

(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关反应的离子方程式
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为

您最近一年使用:0次
名校
解题方法
2 . 卤族元素及其化合物种类繁多,有着非常重要的用途,回答下列问题:
(1)基态Br原子的电子排布式为[Ar]____ 。
(2)同一条件下,HF的沸点____ HCl(填“大于”“等于”或“小于”,以下同)。HF在水中的溶解度____ HCl,原因是____ 。SOCl2中心S原子VSEPR模型为____ 。1mol氟硼酸铵NH4BF4中含有____ mol配位键。
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为( ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为____ ,距离Hg最近的Ag有____ 个。设NA为阿伏加德罗常数的值,Ag2HgI4的摩尔质量为Mg·mol-1,该晶体的密度为____ g·cm-3(用代数式表示)。

(1)基态Br原子的电子排布式为[Ar]
(2)同一条件下,HF的沸点
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为(
 ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为
您最近一年使用:0次
解题方法
3 . 铁在人类物质文明的发展进程中起到重要的作用。回答下列问题:
(1)人体血液中含有铁元素,其存在形式的基态电子排布式为_______ 。
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在,其中Fe采取的杂化类型为_______ ,固态FeCl3的晶体类型为_______ 。
(3)Fe能与CO形成配合物Fe(CO)5。该配合物分子中有_______ 个σ键和_______ 个π键,所含三种元素原子的第一电离能从大到小的顺序为:_______ ,CH4的键角比H2O大的原因是:_______ 。
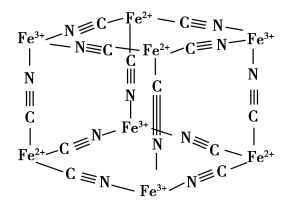
(4)Fe3+离子和K4[Fe(CN)6]反应生成蓝色沉淀,被称为普鲁士蓝,普鲁士蓝颜色很深,原因是_______ ,其晶体部分结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),Fe3+在晶体中的配位数是_______ ,已知图示立方体边长为a pm,则该晶体密度为_______ g·cm-3(写出表达式,用NA表示阿伏加德罗常数的值)。
(1)人体血液中含有铁元素,其存在形式的基态电子排布式为
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在,其中Fe采取的杂化类型为
(3)Fe能与CO形成配合物Fe(CO)5。该配合物分子中有
(4)Fe3+离子和K4[Fe(CN)6]反应生成蓝色沉淀,被称为普鲁士蓝,普鲁士蓝颜色很深,原因是

您最近一年使用:0次
解题方法
4 . 近年来我国在高温超导材料的研究取得了重大突破,高温超导体仅出现在共价性很强的氧化物中,例如带有直线形的Cu-O-Cu链节的网格层对超导性有重要的作用。回答下列问题:
(1)基态Cu原子核外电子排布式为______ 。
(2)氧与其同周期且相邻两元素的第一电离能由大到小的顺序为______ 。
(3)氧的常见氢化物有两种,分别为H2O和H2O2。其中H2O的VSEPR模型为______ ;H2O2中氧原子的杂化方式为_______ 。
(4)硫酸铜溶于水后形成的水合铜离子的结构式为____ ,向硫酸铜溶液中逐滴加入氨水直至过量,观察到的现象为___ ,所得结论:与Cu2+形成配位键的能力H2O___ (填“强于”或“弱于”)NH3
(5)由Y、Ba、Cu、O四种元素构成的高温超导材料晶胞结构如图甲,图乙为沿z轴的投影图;其中CuO2网格层如图丙。
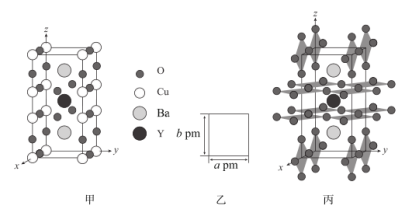
已知:网格层之间相互垂直或平行;z轴方向上的晶胞参数为cpm。
①该高温超导材料的化学式为______ 。
②若阿伏加德罗常数的值为NA,则晶体的密度为_____ g·cm-3(用含a、b、c和NA的表达式表示)。
(1)基态Cu原子核外电子排布式为
(2)氧与其同周期且相邻两元素的第一电离能由大到小的顺序为
(3)氧的常见氢化物有两种,分别为H2O和H2O2。其中H2O的VSEPR模型为
(4)硫酸铜溶于水后形成的水合铜离子的结构式为
(5)由Y、Ba、Cu、O四种元素构成的高温超导材料晶胞结构如图甲,图乙为沿z轴的投影图;其中CuO2网格层如图丙。

已知:网格层之间相互垂直或平行;z轴方向上的晶胞参数为cpm。
①该高温超导材料的化学式为
②若阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
2022-01-22更新
|
1045次组卷
|
4卷引用:安徽省“皖南八校”2022届高三下学期第三次联考理综化学试题
安徽省“皖南八校”2022届高三下学期第三次联考理综化学试题广东省肇庆市2021-2022学年高三第二次模拟考试化学试题广东省2021-2022学年高三一轮复习质量检测化学试题(已下线)【直击双一流】06-备战2022年高考化学名校进阶模拟卷(通用版)
名校
解题方法
5 . 硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式:________ 。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是__________ 。
(3)BF3分子中中心原子的杂化轨道类型是____ 。又知若有d轨道参与杂化,能大大提高中心原子的成键能力,分析BF3、SiF4水解的产物中, 除了相应的酸外,前者生成BF4-而后者生成SiF62-的原因:_______________ 。
(4)NaBH4被认为是有机化学中的“万能还原剂”,NaBH4的电子式为_________ ,其中三种元素的电负性由大到小的顺序是_______________ 。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 Na2B4O7•10H2O,实际上它的结构单元是由两个H3BO3和两个B(OH)4]-(合而成的双六元环,应该写成 Na2[B4O5(OH)4]•8H2O,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是______________ (填字母)。

A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
(6)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的_____ (填“立方体”“正四面体”或“正八面体”)空隙。建立如图所示坐标系,可得晶胞中A、C处原子的分数坐标,则N处的P原子分数坐标为______ 。若晶胞中硼原子和磷原子之间的最近核间距为a pm,则晶胞边长为____________ cm。
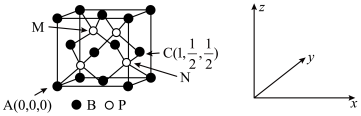
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式:
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是
(3)BF3分子中中心原子的杂化轨道类型是
(4)NaBH4被认为是有机化学中的“万能还原剂”,NaBH4的电子式为
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 Na2B4O7•10H2O,实际上它的结构单元是由两个H3BO3和两个B(OH)4]-(合而成的双六元环,应该写成 Na2[B4O5(OH)4]•8H2O,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是

A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
(6)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的

您最近一年使用:0次
2020-04-09更新
|
197次组卷
|
2卷引用:安徽省合肥市肥东县综合高中2021-2022学年高三下学期期中考试理科综合化学试题
6 . 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________ ,该元素的符号是__________ ;
(2)Y元素原子的价层电子的轨道表示式为________ ,该元素的名称是__________ ;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________ ;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________ ;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____ 。
(1)X元素原子基态时的电子排布式为
(2)Y元素原子的价层电子的轨道表示式为
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由
您最近一年使用:0次
2019-01-30更新
|
1006次组卷
|
15卷引用:安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题
安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)2009年普通高等学校招生统一考试理综试题化学部分(宁夏卷)2014-2015河北省邢台市第一中学高二12月月考化学试卷2014-2015学年吉林省吉林市第一中学高二下期末化学试卷河北省蠡县中学2016-2017学年高二6月月考化学试题河北省廊坊市第一中学2016-2017学年高二下学期6月月考化学试题宁夏青铜峡市高级中学2018届高三上学期期中考试化学试题【全国百强校】宁夏银川唐徕回民中学2017-2018学年高二下学期期中考试化学试题云南省大关县一中2018-2019学年高二上学期12月考试化学试题云南省元江哈尼族彝族傣族自治县一中2018-2019学年高二上学期12月考试化学试题云南省盐津县第一中学2018-2019学年高二上学期12月份考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题云南省玉溪市元江县第一中学2018-2019学年高二下学期开学考试化学试题山东省聊城市2019-2020学年高三化学一轮复习《物质结构与性质(》模拟测试



