名校
1 . 2021 年1月20日中国科学院和中国工程院评选出 2020 年世界十大科技进展,排在第四位的是一种可借助光将二氧化碳转化为甲烷的新型催化转化方法:CO2+4H2=CH4+2H2O,这是迄今最接近人造光合作用的方法。CO2可转化为CO、H2等燃料:CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1,下列有关CO2、CH4的说法正确的是
| A.CH4的空间构型是三角锥形 |
| B.电负性由大到小的顺序是O>C>H |
| C.C原子的电子排布式为1s22s22p4 |
| D.CO2转化为CH4利用了CO2的还原性 |
您最近一年使用:0次
2 . 乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)3]均属于胺,二者均为有机化合物,已知:乙二胺能与MgCl2、CuCl2溶液等中的金属离子形成相对稳定的配离子,如[Cu(En)2]2+(En是乙二胺的简写),结构如图所示,下列有关说法正确的是


| A.三甲胺分子中的N与三个C原子构成三角锥形 |
| B.H2O比乙二胺更易与Cu2+形成稳定的配合物 |
| C.乙二胺比三甲胺的沸点低 |
| D.[Cu(En)2]2+配离子中Cu2+的配位数为2 |
您最近一年使用:0次
2021-04-30更新
|
211次组卷
|
3卷引用:福建省龙岩市长汀、连城、上杭、武平、漳平、永定六校(一中)2020-2021学年高二下学期期中联考化学试题
18-19高二下·吉林·阶段练习
解题方法
3 . A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大。A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图(D的氢化物沸点最高);F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
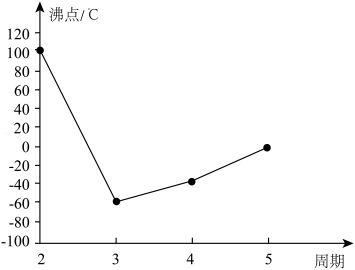
(1)写出F元素基态原子的核外电子排布式:____________ 。
(2)B、C、D三种元素电负性由大到小的顺序是____________ (用元素符号表示)。
(3)有关上述元素的下列说法,正确的是________ (填序号)。
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的立体构型为________ ,1 mol B2A4分子中含有________ 个σ键;

(1)写出F元素基态原子的核外电子排布式:
(2)B、C、D三种元素电负性由大到小的顺序是
(3)有关上述元素的下列说法,正确的是
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的立体构型为
您最近一年使用:0次
名校
解题方法
4 . 下列关于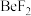 和
和 的说法正确的是
的说法正确的是
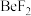 和
和 的说法正确的是
的说法正确的是A.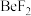 分子中,中心原子Be的价层电子对数等于2,成键电子对数等于2,其空间结构为直线形 分子中,中心原子Be的价层电子对数等于2,成键电子对数等于2,其空间结构为直线形 |
B. 分子中,中心原子S的价层电子对数等于4,成键电子对数等于2,其空间结构为四面体形 分子中,中心原子S的价层电子对数等于4,成键电子对数等于2,其空间结构为四面体形 |
C.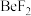 和 和 分子的VSEPR模型分别为直线形和V形 分子的VSEPR模型分别为直线形和V形 |
D. 的键角比 的键角比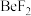 的大 的大 |
您最近一年使用:0次
2021-02-19更新
|
779次组卷
|
4卷引用:(人教版2019)选择性必修2 第二章 分子结构与性质 C高考挑战区
解题方法
5 . 过渡元素在生活、生产和科技等方面有广泛的用途。
(1)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为 ,
, ,
, 代表聚合度}在水体中形成絮状物,吸附重金属离子。下列说法不正确的是
代表聚合度}在水体中形成絮状物,吸附重金属离子。下列说法不正确的是_______ (填标号)。
A.PFS中铁元素显+2价
B.基态铁原子的价层电子排布式是
C.由 溶液制PFS需经过氧化、水解和聚合的过程
溶液制PFS需经过氧化、水解和聚合的过程
D.由上表可知,气态 失去一个电子比气态
失去一个电子比气态 失去一个电子难
失去一个电子难
(2)PFS中 的中心原子采取
的中心原子采取_______ 杂化,空间结构是_______ 。
(3)O、S、Se为同主族元素, 、
、 和
和 的一些参数如表所示。
的一些参数如表所示。
 的键角大于
的键角大于 的键角,原因可能为
的键角,原因可能为_______ 。
(1)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为
 ,
, ,
, 代表聚合度}在水体中形成絮状物,吸附重金属离子。下列说法不正确的是
代表聚合度}在水体中形成絮状物,吸附重金属离子。下列说法不正确的是电离能/( | Mn | Fe |
I1 | 717 | 759 |
I2 | 1509 | 1561 |
I3 | 3248 | 2957 |
A.PFS中铁元素显+2价
B.基态铁原子的价层电子排布式是

C.由
 溶液制PFS需经过氧化、水解和聚合的过程
溶液制PFS需经过氧化、水解和聚合的过程D.由上表可知,气态
 失去一个电子比气态
失去一个电子比气态 失去一个电子难
失去一个电子难(2)PFS中
 的中心原子采取
的中心原子采取(3)O、S、Se为同主族元素,
 、
、 和
和 的一些参数如表所示。
的一些参数如表所示。化学式 | 键长/nm | 键角 |
| 0.96 | 105° |
| 1.34 | 92.3° |
| 1.47 | 91.0° |
 的键角大于
的键角大于 的键角,原因可能为
的键角,原因可能为
您最近一年使用:0次
2021-02-17更新
|
223次组卷
|
2卷引用:(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构
解题方法
6 . UO2与铀氮化物是重要的核燃料,已知:3(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O。回答下列问题:
3UO2+10NH3↑+9CO2↑+N2↑+9H2O。回答下列问题:
(1)基态氮原子价电子排布图为__ 。
(2)反应所得气态化合物中属于非极性分子的是__ (填化学式)。
(3)某种铀氮化物的晶体结构与NaCl的结构相似。NaCl的Born-Haber循环如图甲所示。已知:元素的一个基态气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是___ (填序号)。

a.Cl—Cl键的键能为119.6kJ•mol-1
b.Na的第一电离能为603.4kJ•mol-1
c.Cl的第一电子亲和能为348.3kJ•mol-1
(4)依据VSEPR理论推测CO 的空间结构为
的空间结构为__ 。分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ,则CO
,则CO 中的大π键应表示为
中的大π键应表示为___ 。
(5)UO2可用于制备UF4:2UO2+5NH4HF2 2UF4•2NH4F+3NH3↑+4H2O↑,其中HF
2UF4•2NH4F+3NH3↑+4H2O↑,其中HF 的结构可表示为[F—H…F]-,反应中断裂的化学键有
的结构可表示为[F—H…F]-,反应中断裂的化学键有__ (填序号)。
a.氢键 b.极性键 c.离子键 d.金属键 e.非极性键
(6)铀氮化物的某两种晶胞如图乙所示:

①晶胞a中铀元素的化合价为___ ,与U原子距离相等且最近的U原子有__ 个。
②已知晶体b的密度为dg•cm-3,U原子的半径为r1cm,N原子的半径为r2cm,设NA为阿伏加德罗常数的值,则该晶胞原子的空间利用率为__ (列出计算式)。
 3UO2+10NH3↑+9CO2↑+N2↑+9H2O。回答下列问题:
3UO2+10NH3↑+9CO2↑+N2↑+9H2O。回答下列问题:(1)基态氮原子价电子排布图为
(2)反应所得气态化合物中属于非极性分子的是
(3)某种铀氮化物的晶体结构与NaCl的结构相似。NaCl的Born-Haber循环如图甲所示。已知:元素的一个基态气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是

a.Cl—Cl键的键能为119.6kJ•mol-1
b.Na的第一电离能为603.4kJ•mol-1
c.Cl的第一电子亲和能为348.3kJ•mol-1
(4)依据VSEPR理论推测CO
 的空间结构为
的空间结构为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ,则CO
,则CO 中的大π键应表示为
中的大π键应表示为(5)UO2可用于制备UF4:2UO2+5NH4HF2
 2UF4•2NH4F+3NH3↑+4H2O↑,其中HF
2UF4•2NH4F+3NH3↑+4H2O↑,其中HF 的结构可表示为[F—H…F]-,反应中断裂的化学键有
的结构可表示为[F—H…F]-,反应中断裂的化学键有a.氢键 b.极性键 c.离子键 d.金属键 e.非极性键
(6)铀氮化物的某两种晶胞如图乙所示:

①晶胞a中铀元素的化合价为
②已知晶体b的密度为dg•cm-3,U原子的半径为r1cm,N原子的半径为r2cm,设NA为阿伏加德罗常数的值,则该晶胞原子的空间利用率为
您最近一年使用:0次
7 . 关于CO2说法正确的是( )
| A.CO2是直线型结构 | B.碳原子采取sp3杂化 |
| C.CO2分子中含非极性键 | D.CO2为极性分子 |
您最近一年使用:0次
2020-11-21更新
|
266次组卷
|
2卷引用:北京市第四十三中学2020-2021学年高二下学期第一次月考化学试题
8 . 设NA为阿伏加 德罗常数的值,下列说法中正确的是
| A.标准状况下,1mol金刚石中含有的C–C键数目为4NA |
| B.1mol SiO2晶体中含有的Si–O键数目为2NA |
| C.63g HNO3,中心原子N的价层电子对中,孤电子对数为NA |
| D.常温常压下,1mol配合物[Cu(NH3)4]SO4中,含有的σ键数目为20NA |
您最近一年使用:0次
2019-06-09更新
|
300次组卷
|
2卷引用:2021年湖北高考化学试题变式题1-10
名校
解题方法
9 . W、X、Y、Z均为短周期元素且原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,Y与W形成的阴离子(如图所示)中W不满足8电子稳定结构,W与Z的最高价之和为8。下列说法中正确的是( )


| A.W、X、Z可形成离子化合物 |
| B.Z2O是某种弱酸的酸酐,且为直线型分子 |
| C.W与X形成的二元化合物只能含极性键 |
| D.X、Z形成氧化物对应水化物的酸性:Z>X |
您最近一年使用:0次
2020-07-02更新
|
967次组卷
|
2卷引用:2021年湖北高考化学试题变式题1-10
2020高三·全国·专题练习
名校
解题方法
10 . X、Y、Z是三种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期,X原子的最外层电子排布式是2s22p4,Z原子的核外电子数比Y原子少1,下列说法不正确的是
| A.CX2(C是原子核内含6个质子的元素)分子是非极性分子 |
| B.ZH3的VSEPR模型名称为三角锥形 |
| C.Z4分子是非极性分子 |
| D.酸H2YO4比酸H3ZO4的酸性强 |
您最近一年使用:0次
2020-02-12更新
|
345次组卷
|
5卷引用:第31讲 分子结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
(已下线)第31讲 分子结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)2020届高三化学二轮物质结构题型专攻——分子的性质【选择基础专练】四川省宜宾市叙州区第二中学校2019-2020学年高二下学期期中考试化学试题(已下线)专题十 物质结构与性质(选择性必修2)能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)吉林省吉林市第一中学2022-2023学年高二上学期期末测试化学试题

 )
)

