21-22高三上·江苏·期中
名校
解题方法
1 . 肼(N2H4)又称为联氨,熔、沸点分别为1.4°C、113.5°C,可用如下方法制备肼:CO(NH2)2+ClO- +2OH- =N2H4+Cl-+CO +H2O。下列有关说法正确的是
+H2O。下列有关说法正确的是
 +H2O。下列有关说法正确的是
+H2O。下列有关说法正确的是| A.N2H4中只存在极性键 |
B. CO 的空间构型为三角锥形 的空间构型为三角锥形 |
| C.CO(NH2)2中C、N、O三种元素第一电离能大小顺序是:C<N<O |
| D.肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是能形成分子间氢键 |
您最近一年使用:0次
2021-11-28更新
|
420次组卷
|
5卷引用:山东省济宁市2021-2022学年高三上学期期末考试化学试题
名校
解题方法
2 . A、B、C、D 4种短周期元素,原子序数依次增大。其元素相关信息如下表。
(1)元素A、B、C中,电负性最大的是_______ (填元素符号)。
(2)A与B形成共价化合物 ,其分子的空间结构呈
,其分子的空间结构呈_______ 形。
(3) 易溶于
易溶于 中的原因是
中的原因是_______ 。
(4)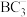 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为_______ ;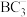 的空间结构为
的空间结构为_______ 。
(5)B和D两种元素组成的化合物是共价晶体,其晶胞如下图所示,则表示该化合物的化学式为_______ (请用元素符号表示)。
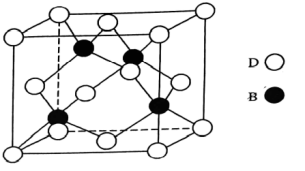
| 元素 | 信息 |
| A | 元素原子的核外电子只有一种运动状态 |
| B | 价电子层中的未成对电子有3个 |
| C | 最外层电子数为其内层电子数的3倍 |
| D | 离子半径在同周期金属元素中最小 |
(1)元素A、B、C中,电负性最大的是
(2)A与B形成共价化合物
 ,其分子的空间结构呈
,其分子的空间结构呈(3)
 易溶于
易溶于 中的原因是
中的原因是(4)
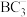 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为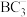 的空间结构为
的空间结构为(5)B和D两种元素组成的化合物是共价晶体,其晶胞如下图所示,则表示该化合物的化学式为

您最近一年使用:0次
2021-07-20更新
|
215次组卷
|
2卷引用:北京市密云区2020-2021学年高二下学期期末考试化学试题
名校
解题方法
3 .  是常用的还原剂,下列有关说法正确的是
是常用的还原剂,下列有关说法正确的是
 是常用的还原剂,下列有关说法正确的是
是常用的还原剂,下列有关说法正确的是A. 中心原子的杂化方式是 中心原子的杂化方式是 杂化,其阴离子的空间构型是正四面体形 杂化,其阴离子的空间构型是正四面体形 |
B. 中存在离子键、 中存在离子键、 键、氢键 键、氢键 |
| C.该化合物中,H元素呈-1价,易被还原 |
D.Li原子电子排布图(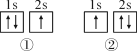 )表示的状态中,能量高的是① )表示的状态中,能量高的是① |
您最近一年使用:0次
2021-07-13更新
|
430次组卷
|
2卷引用:河南省信阳市2020-2021学年高二下学期期末考试化学试题
名校
解题方法
4 . 下列说法不正确 的是
A. 比 比 的沸点高,是由于 的沸点高,是由于 分子间存在氢键 分子间存在氢键 |
B. 的VSEPR模型与其离子空间构型是一致的 的VSEPR模型与其离子空间构型是一致的 |
C.价层电子对互斥模型中, 键电子对数不计入中心原子的价层电子对数 键电子对数不计入中心原子的价层电子对数 |
D. 的VSEPR模型是正四面体形,因此 的VSEPR模型是正四面体形,因此 分子是非极性分子 分子是非极性分子 |
您最近一年使用:0次
2021-07-12更新
|
286次组卷
|
3卷引用:北京市东城区2020-2021学年高二下学期期末考试化学试题
解题方法
5 . 1824年,德国化学家维勒蒸发氰酸铵( )溶液,得到一种白色结晶物,经多次实验,证实该白色结晶物与从动物尿液中提取的尿素
)溶液,得到一种白色结晶物,经多次实验,证实该白色结晶物与从动物尿液中提取的尿素 一致。维勒利用无机物人工合成了尿素,破除了人们长期以来形成的有机物“生命力论”的错误观念。
一致。维勒利用无机物人工合成了尿素,破除了人们长期以来形成的有机物“生命力论”的错误观念。
(1)从物质的组成和结构角度分析: 与
与 的关系为
的关系为___________ 。
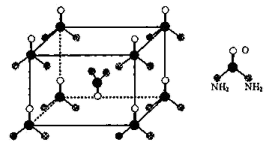
(2)尿素晶体的晶胞结构如图所示,该晶胞中有___________ 个尿素分子。
(3)硝酸铁和尿素在乙醇溶液中可以合成 [三硝酸六尿素合铁(Ⅲ)]。
[三硝酸六尿素合铁(Ⅲ)]。
①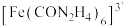 中基态中心离子的核外电子排布式是
中基态中心离子的核外电子排布式是___________ , 的空间结构是
的空间结构是___________ 。
②实验发现,其他条件相同时,乙醇溶液浓度越大,析出的三硝酸六尿素合铁(Ⅲ)晶体越多。其原因是___________ 。
(4)电子亲和能是指元素的气态原子(或离子)获得一个电子所放出的能量。一般来说,原子(或离子)越容易获得电子,则电子亲和能越大;原子(或离子)外层电子构型越稳定,电子亲和能越小。 元素的第一电子亲和能远低于
元素的第一电子亲和能远低于 元素的原因是
元素的原因是___________ 。
 )溶液,得到一种白色结晶物,经多次实验,证实该白色结晶物与从动物尿液中提取的尿素
)溶液,得到一种白色结晶物,经多次实验,证实该白色结晶物与从动物尿液中提取的尿素 一致。维勒利用无机物人工合成了尿素,破除了人们长期以来形成的有机物“生命力论”的错误观念。
一致。维勒利用无机物人工合成了尿素,破除了人们长期以来形成的有机物“生命力论”的错误观念。
(1)从物质的组成和结构角度分析:
 与
与 的关系为
的关系为(2)尿素晶体的晶胞结构如图所示,该晶胞中有
(3)硝酸铁和尿素在乙醇溶液中可以合成
 [三硝酸六尿素合铁(Ⅲ)]。
[三硝酸六尿素合铁(Ⅲ)]。①
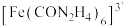 中基态中心离子的核外电子排布式是
中基态中心离子的核外电子排布式是 的空间结构是
的空间结构是②实验发现,其他条件相同时,乙醇溶液浓度越大,析出的三硝酸六尿素合铁(Ⅲ)晶体越多。其原因是
(4)电子亲和能是指元素的气态原子(或离子)获得一个电子所放出的能量。一般来说,原子(或离子)越容易获得电子,则电子亲和能越大;原子(或离子)外层电子构型越稳定,电子亲和能越小。
 元素的第一电子亲和能远低于
元素的第一电子亲和能远低于 元素的原因是
元素的原因是
您最近一年使用:0次
解题方法
6 . 钴及其化合物在电机、机械、化工、航空和航天等工业部门得到广泛的应用,是一种重要的战略金属。已知:钴是具有光泽的钢灰色金属,其常见价态有+2价、+3价,化学性质与铁类似。
(1)三价钴离子的核外电子排布式为__ 。
(2)配合物[Co(NH3)4(H2O)2]C13是钴的重要化合物,中心原子的配位数为____ ,配体分子的VSEPR模型为___ 。
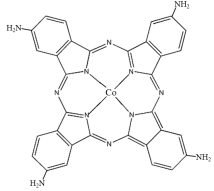
(3)化合物四氨基钴酞菁分子的结构式如图。四氨基钴酞菁中N原子的杂化轨道类型为__ 、___ 。
(4)已知Co(OH)2具有明显的两性,在浓的强碱溶液中可以形成[Co(OH)4]2-,写出Co(OH)2酸式电离的电离方程式_______ 。
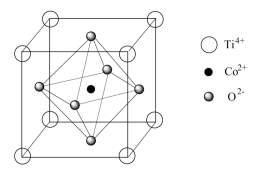
(5)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,该钴的化合物的化学式是_______ 。已知晶胞参数为acm,NA为阿伏加德罗常数的值,则该钴的化合物的密度为_______ g/cm3。
(1)三价钴离子的核外电子排布式为
(2)配合物[Co(NH3)4(H2O)2]C13是钴的重要化合物,中心原子的配位数为
(3)化合物四氨基钴酞菁分子的结构式如图。四氨基钴酞菁中N原子的杂化轨道类型为

(4)已知Co(OH)2具有明显的两性,在浓的强碱溶液中可以形成[Co(OH)4]2-,写出Co(OH)2酸式电离的电离方程式
(5)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,该钴的化合物的化学式是

您最近一年使用:0次



