解题方法
1 . 按要求回答下列问题:
(1)前三周期元素中,基态原子核外有7组成对电子的原子,其价层电子的轨道表示式为___________ 。
(2)已知H2O2的沸点为152℃,H2S的沸点-60.4℃。请解释两者沸点差异的原因___________ 。
(3)BF3和NaBF4是硼的重要化合物,微粒中F-B-F键角:BF3___________  (填“>”、“<”或“=” )。理由是
(填“>”、“<”或“=” )。理由是___________ 。
(4)将CH3COOH、FCH2COOH、CH3CH2COOH的酸性由强到弱排序___________ ,并解释原因___________ 。
(1)前三周期元素中,基态原子核外有7组成对电子的原子,其价层电子的轨道表示式为
(2)已知H2O2的沸点为152℃,H2S的沸点-60.4℃。请解释两者沸点差异的原因
(3)BF3和NaBF4是硼的重要化合物,微粒中F-B-F键角:BF3
 (填“>”、“<”或“=” )。理由是
(填“>”、“<”或“=” )。理由是(4)将CH3COOH、FCH2COOH、CH3CH2COOH的酸性由强到弱排序
您最近一年使用:0次
解题方法
2 . 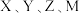 是原子半径依次减小的短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素的第一电离能比Z的第一电离能大,M的电负性比X的小。下列说法
是原子半径依次减小的短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素的第一电离能比Z的第一电离能大,M的电负性比X的小。下列说法不正确 的是
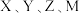 是原子半径依次减小的短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素的第一电离能比Z的第一电离能大,M的电负性比X的小。下列说法
是原子半径依次减小的短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素的第一电离能比Z的第一电离能大,M的电负性比X的小。下列说法A.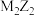 中所有原子共直线 中所有原子共直线 |
B.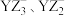 的 的 模型相同 模型相同 |
C. 的简单气态氢化物的沸点依次升高 的简单气态氢化物的沸点依次升高 |
D.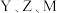 形成的化合物可以是酸、碱或盐 形成的化合物可以是酸、碱或盐 |
您最近一年使用:0次
解题方法
3 . 白磷(P4)在Cl2中燃烧生成PCl3和PCl5。下列说法正确的是
| A.P4分子中每个磷原子价层电子对数为4 |
| B.PCl3的空间构型为平面正三角形 |
| C.PCl5分子中P原子最外层满足8电子结构 |
| D.因P电负性比Cl小,故PCl3的水解产物为PH3和HClO |
您最近一年使用:0次
名校
4 . 工业上电解氧化铝时常加入冰晶不,制取冰晶石的反应方程式为: ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A. 的VSEPR模型为V形 的VSEPR模型为V形 |
B. 在水中的电离方程式为: 在水中的电离方程式为: |
C.由铝原子核形成的下列三种微粒:a. b. b. ,再失去一个电子所需最低能量由大到小的顺序是: ,再失去一个电子所需最低能量由大到小的顺序是: |
D. 为直线形结构,分子中存在大 为直线形结构,分子中存在大 键: 键: |
您最近一年使用:0次
2024-02-27更新
|
198次组卷
|
2卷引用:山东省青岛第五十八中学2023-2024学年高二上学期期末化学试卷
名校
解题方法
5 . 回答下列问题。
(1)写出基态As原子的简化电子排布式:___________ ,其核外有___________ 种不同空间运动状态的电子。
(2)1 mol [Ni(NH3)6]SO4中σ键的数目为___________ NA。
(3)SCN-中C原子的杂化轨道类型为___________ ,其中含有两个相同的大π键,其形式为___________ (用 表示,n为原子数,m为电子数),检验Fe3+时,SCN-以S原子配位不以N原子配位的原因是
表示,n为原子数,m为电子数),检验Fe3+时,SCN-以S原子配位不以N原子配位的原因是___________ 。
(4)某主族元素的电离能I1~I7数据如表所示(单位:kJ/mol),可推测该元素位于元素周期表第___________ 族。
(5)光气(COCl2)分子中,所有原子均满足8电子稳定结构,其电子式为___________ 。
(6)下列酸中:CF3COOH、CCl3COOH、CHCl2COOH、CH2ClCOOH,酸性最强的是___________ 。
(7)已知:硫代乙酰胺(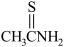 )在酸性溶液中会水解为乙酰胺(
)在酸性溶液中会水解为乙酰胺(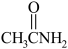 )和硫化氢,硫代乙酰胺比乙酰胺的沸点低,解释其原因为
)和硫化氢,硫代乙酰胺比乙酰胺的沸点低,解释其原因为___________ 。
(8)H3BO3分子中的O-B-O的键角___________ (填“大于”“等于”或“小于”) 中的H-B-H的键角,判断依据是
中的H-B-H的键角,判断依据是___________ 。
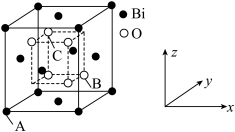
(9)Bi2O3的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为( ,
, ,
, ),则C点坐标为
),则C点坐标为___________ 。
(1)写出基态As原子的简化电子排布式:
(2)1 mol [Ni(NH3)6]SO4中σ键的数目为
(3)SCN-中C原子的杂化轨道类型为
 表示,n为原子数,m为电子数),检验Fe3+时,SCN-以S原子配位不以N原子配位的原因是
表示,n为原子数,m为电子数),检验Fe3+时,SCN-以S原子配位不以N原子配位的原因是(4)某主族元素的电离能I1~I7数据如表所示(单位:kJ/mol),可推测该元素位于元素周期表第
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 578 | 1817 | 2748 | 11575 | 14830 | 18376 | 23293 |
(5)光气(COCl2)分子中,所有原子均满足8电子稳定结构,其电子式为
(6)下列酸中:CF3COOH、CCl3COOH、CHCl2COOH、CH2ClCOOH,酸性最强的是
(7)已知:硫代乙酰胺(
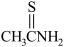 )在酸性溶液中会水解为乙酰胺(
)在酸性溶液中会水解为乙酰胺(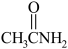 )和硫化氢,硫代乙酰胺比乙酰胺的沸点低,解释其原因为
)和硫化氢,硫代乙酰胺比乙酰胺的沸点低,解释其原因为(8)H3BO3分子中的O-B-O的键角
 中的H-B-H的键角,判断依据是
中的H-B-H的键角,判断依据是(9)Bi2O3的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为(
 ,
, ,
, ),则C点坐标为
),则C点坐标为
您最近一年使用:0次
6 . 完成表中内容。
| σ数 | 孤电子对数 | 杂化方式 | VSEPR模型 | 分子空间构型 | |
| CO2 | |||||
| H2O |
您最近一年使用:0次
2024-02-24更新
|
253次组卷
|
3卷引用:新疆博湖县奇石中学2022-2023学年高二下学期期末考试化学试题
名校
解题方法
7 . 元素A、D、E、W、X、Y、Z基态原子,原子序数依次增大且分占前四周期,D的各能级电子数相等;E的核外电子有3种空间运动状态。W的价电子排布式为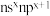 ,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:
,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:
(1)Z元素在周期表中的位置为:___________ ;位于周期表___________ 区。
(2)D、E、W元素第一电离能由大到小顺序为:___________ ;电负性由大到小顺序为:___________ 。
(3)比较键角:
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)实验测得:ZY属于共价化合物,气态ZY分子的相对分子质量为199,该分子中含有配位键,则气态ZY分子的结构式可能为___________ 。
(5)某物质晶胞结构如图所示。
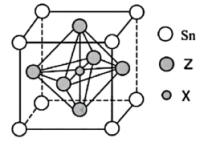
①该物质的化学式可以表示为___________ 。
②该晶胞中距离最近的 与Z原子的核间距为
与Z原子的核间距为 ,则该晶胞的密度为
,则该晶胞的密度为___________  (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
 ,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:
,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:(1)Z元素在周期表中的位置为:
(2)D、E、W元素第一电离能由大到小顺序为:
(3)比较键角:

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)实验测得:ZY属于共价化合物,气态ZY分子的相对分子质量为199,该分子中含有配位键,则气态ZY分子的结构式可能为
(5)某物质晶胞结构如图所示。

①该物质的化学式可以表示为
②该晶胞中距离最近的
 与Z原子的核间距为
与Z原子的核间距为 ,则该晶胞的密度为
,则该晶胞的密度为 (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
您最近一年使用:0次
8 . 亚硫酸盐是一类很早即在世界范围内广泛使用的食品添加剂,可作为食品漂白剂,防腐剂;可抑制非酶褐变和酶促褐变,防止食品褐变,使水果不至黑变,还能防止鲜虾生成黑斑;在酸性介质中,还是十分有效的抗菌剂。
(1)亚硫酸钠中,阴离子的空间结构为___________ 。
(2)常温下, 溶液呈碱性,原因是
溶液呈碱性,原因是___________ (用离子方程式表示)。
(3)常温下,已知 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
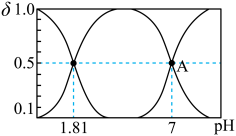
①A点溶液中离子浓度大小关系为___________ 。
②常温下, 溶液呈
溶液呈___________ 性,原因是___________ 。
(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是___________ (用离子方程式表示)。常温处理后,再调节 使
使 浓度不高于
浓度不高于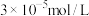 即可排放,调节
即可排放,调节 应不低于
应不低于___________ 。[已知Ksp[Cr(OH)3]=3×10-32]
(1)亚硫酸钠中,阴离子的空间结构为
(2)常温下,
 溶液呈碱性,原因是
溶液呈碱性,原因是(3)常温下,已知
 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
①A点溶液中离子浓度大小关系为
②常温下,
 溶液呈
溶液呈(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性
 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是 使
使 浓度不高于
浓度不高于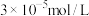 即可排放,调节
即可排放,调节 应不低于
应不低于
您最近一年使用:0次
名校
9 . 燃油汽车尾气中含有 和氮氧化物,氮氧化物包括
和氮氧化物,氮氧化物包括 等,研究
等,研究 还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。
还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。
(1)已知:
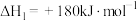 ,
, 的燃烧热为
的燃烧热为 。写出
。写出 与
与 催化转化成
催化转化成 和
和 的热化学方程式
的热化学方程式___________ 。
(2)在 的催化作用下,
的催化作用下, 还原
还原 的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
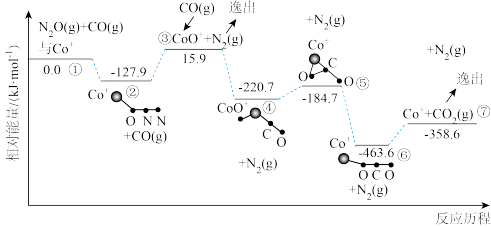
①分析反应历程,

_____  ;
; 分子的中心原子是
分子的中心原子是_____ 。
②该反应分两步进行:a. ;b.
;b._____ 。历程中决定反应速率的变化过程是_____ 。
A.②③ B.③④ C.⑤⑥ D.⑥⑦
(3) 和恒定压强
和恒定压强 时,在密闭容器中模拟某种废气中
时,在密闭容器中模拟某种废气中 直接催化分解过程,分解过程主反应为
直接催化分解过程,分解过程主反应为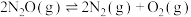 。反应前后各组分的信息如下表:
。反应前后各组分的信息如下表:
分析数据,写出一个 分解的副反应的化学方程式:
分解的副反应的化学方程式:_____ 。该温度下主反应的
_____  (以分压表示,分压=总压
(以分压表示,分压=总压 物质的量分数)。若除去废气中的
物质的量分数)。若除去废气中的 气体,在相同的条件下模拟实验,发现体系中
气体,在相同的条件下模拟实验,发现体系中 的平衡转化率明显降低,解释其原因:
的平衡转化率明显降低,解释其原因:_____ 。
 和氮氧化物,氮氧化物包括
和氮氧化物,氮氧化物包括 等,研究
等,研究 还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。
还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。(1)已知:

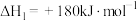 ,
, 的燃烧热为
的燃烧热为 。写出
。写出 与
与 催化转化成
催化转化成 和
和 的热化学方程式
的热化学方程式(2)在
 的催化作用下,
的催化作用下, 还原
还原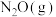 的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
①分析反应历程,


 ;
; 分子的中心原子是
分子的中心原子是②该反应分两步进行:a.
 ;b.
;b.A.②③ B.③④ C.⑤⑥ D.⑥⑦
(3)
 和恒定压强
和恒定压强 时,在密闭容器中模拟某种废气中
时,在密闭容器中模拟某种废气中 直接催化分解过程,分解过程主反应为
直接催化分解过程,分解过程主反应为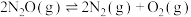 。反应前后各组分的信息如下表:
。反应前后各组分的信息如下表:| 物质 |  |  |  |  |  |  |
 (投料) (投料) | 19 | 34 | 6.5 | 25 | 0 | 0 |
 (平衡) (平衡) | 50 | 1 | 20 | 25 | 2 | 2 |
 分解的副反应的化学方程式:
分解的副反应的化学方程式:
 (以分压表示,分压=总压
(以分压表示,分压=总压 物质的量分数)。若除去废气中的
物质的量分数)。若除去废气中的 气体,在相同的条件下模拟实验,发现体系中
气体,在相同的条件下模拟实验,发现体系中 的平衡转化率明显降低,解释其原因:
的平衡转化率明显降低,解释其原因:
您最近一年使用:0次
2024-02-16更新
|
361次组卷
|
2卷引用:湖南省长沙市长郡中学2024届高三上学期期末适应性考试化学试题
名校
10 . S的含氧酸根有多种,如 ,
, ,
, ,
, 。等,其中
。等,其中 是
是 中的一个O被S取代的产物。下列说法中正确的是
中的一个O被S取代的产物。下列说法中正确的是
 ,
, ,
, ,
, 。等,其中
。等,其中 是
是 中的一个O被S取代的产物。下列说法中正确的是
中的一个O被S取代的产物。下列说法中正确的是A. 中O—S—O的键角为120° 中O—S—O的键角为120° |
B. 与 与 中S的杂化方式相同 中S的杂化方式相同 |
C. 的空间构型为正四面体 的空间构型为正四面体 |
D. 中S与O之间的化学键键长均相等 中S与O之间的化学键键长均相等 |
您最近一年使用:0次



