解题方法
1 . 我国科研工作者发现并制备了一系列主要由N、O、P、Se等元素组成的导电材料。回答下列问题:
(1) 三种元素中,电负性最小的元素名称是
三种元素中,电负性最小的元素名称是___________ ;键角:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)肼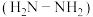 分子中孤电子对与
分子中孤电子对与 键的数目之比为
键的数目之比为___________ ,肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是___________ 。
(3)正硝酸钠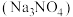 是一种重要的化工原料。
是一种重要的化工原料。 阴离子的空间结构为
阴离子的空间结构为___________ 形,其中心原子杂化方式为___________ 杂化。
(4)基态硒原子的价层电子排布式为___________ ; 晶体的熔点为
晶体的熔点为 ,加热易升华,固态
,加热易升华,固态 属于
属于___________ 晶体。
(1)
 三种元素中,电负性最小的元素名称是
三种元素中,电负性最小的元素名称是
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)肼
 分子中孤电子对与
分子中孤电子对与 键的数目之比为
键的数目之比为(3)正硝酸钠
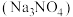 是一种重要的化工原料。
是一种重要的化工原料。 阴离子的空间结构为
阴离子的空间结构为(4)基态硒原子的价层电子排布式为
 晶体的熔点为
晶体的熔点为 ,加热易升华,固态
,加热易升华,固态 属于
属于
您最近一年使用:0次
解题方法
2 . 钛被称为继铁、铝之后的“第三金属”,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。回答下列问题:
(1)基态钛原子的价电子排布式为_______ 。
(2)硫酸氧钛( )中
)中 的空间结构为
的空间结构为_______ , 中心原子的轨道杂化类型为
中心原子的轨道杂化类型为_______ 。
(3)几种卤化钛晶体熔点如下表所示:
 的熔点明显高于
的熔点明显高于 ,原因是
,原因是_______ 。 、
、 、
、 的点依次升高的原因是
的点依次升高的原因是_______ 。
(4)钛的配合物有多种。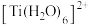 、
、 、
、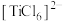 的配体中所含原子电负性由大到小的顺序是
的配体中所含原子电负性由大到小的顺序是_______ ,其中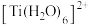 中
中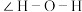
_______ (填“大于”、“小于”或“等于”)单个水分子中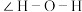 。
。
(5)硼钛二元化合物是一种高熔点、高硬度、抗氧化的新型陶瓷材料,属于六方晶系,其晶体结构如图,该硼钛二元化合物的化学式为_______ 。 型晶体结构,晶胞结构如图所示,若该晶胞的密度为
型晶体结构,晶胞结构如图所示,若该晶胞的密度为 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则晶胞中Ti原子与Ti原子的最近距离为
,则晶胞中Ti原子与Ti原子的最近距离为_______ pm(用含 、
、 的代数式表示)。
的代数式表示)。
(1)基态钛原子的价电子排布式为
(2)硫酸氧钛(
 )中
)中 的空间结构为
的空间结构为 中心原子的轨道杂化类型为
中心原子的轨道杂化类型为(3)几种卤化钛晶体熔点如下表所示:
| 卤化钛 |  |  |  |  |
| 熔点/℃ | 1200 |  | 39 | 150 |
 的熔点明显高于
的熔点明显高于 ,原因是
,原因是 、
、 、
、 的点依次升高的原因是
的点依次升高的原因是(4)钛的配合物有多种。
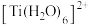 、
、 、
、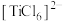 的配体中所含原子电负性由大到小的顺序是
的配体中所含原子电负性由大到小的顺序是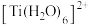 中
中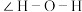
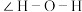 。
。(5)硼钛二元化合物是一种高熔点、高硬度、抗氧化的新型陶瓷材料,属于六方晶系,其晶体结构如图,该硼钛二元化合物的化学式为

 型晶体结构,晶胞结构如图所示,若该晶胞的密度为
型晶体结构,晶胞结构如图所示,若该晶胞的密度为 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则晶胞中Ti原子与Ti原子的最近距离为
,则晶胞中Ti原子与Ti原子的最近距离为 、
、 的代数式表示)。
的代数式表示)。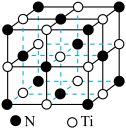
您最近一年使用:0次
解题方法
3 . Cr的某配合物的结构如图所示。
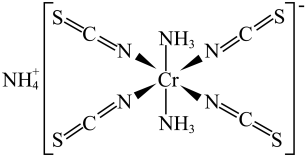
A.键角: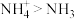 |
| B.基态铬原子有6个未成对电子 |
C. 中三原子在一条线上 中三原子在一条线上 |
D. 该配合物中含 该配合物中含 键的数目为 键的数目为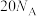 |
您最近一年使用:0次
解题方法
4 . 黄铁矿是制取硫酸的主要原料,其主要成分为FeS2,其中铁元素显+2价,FeS2晶体的晶胞形状为立方体,晶胞结构如图所示。___________ 。
(2)制取硫酸过程中会产生SO3,SO3分子的空间构型为___________ 。
(3)晶胞中与每个S 距离最近且相等的Fe2+有
距离最近且相等的Fe2+有___________ 个。
(4)FeS2晶体的晶胞边长为anm,FeS2的摩尔质量为120g·mol-1,阿伏加德罗常数的值为NA,该FeS2晶体的密度ρ=___________ g·cm-3(1nm=10-7cm,用含a、NA的代数式表示)

(2)制取硫酸过程中会产生SO3,SO3分子的空间构型为
(3)晶胞中与每个S
 距离最近且相等的Fe2+有
距离最近且相等的Fe2+有(4)FeS2晶体的晶胞边长为anm,FeS2的摩尔质量为120g·mol-1,阿伏加德罗常数的值为NA,该FeS2晶体的密度ρ=
您最近一年使用:0次
5 . 离子液体具有较好的化学稳定性、较低的熔点及对无机物、有机化合物等不同物质良好溶解性等优点,在有机合成领域用途广泛。一种离子液体的结构简式如下图。错误 的是
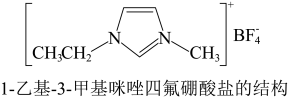
| A.阳离子中C原子有sp2、sp3两种杂化方式 |
| B.阴离子呈平面正方形,存在共价键和配位键 |
| C.该离子液体能与H2O形成氢键 |
| D.熔点低的可能原因是离子体积增大、距离增大、作用力减弱 |
您最近一年使用:0次
6 . 卤化物在生产、生活和科研中应用广泛。请回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ 。
(2)四氟乙烯( )分子中,
)分子中, 键与
键与 键的数目比为
键的数目比为___________ ,C的杂化轨道类型为___________ 。“塑料王”——聚四氟乙烯,其化学稳定性高于聚乙烯,从化学键的角度解释原因___________ 。
(3) 主要用于火箭工程液体助燃剂,其分子的空间构型为
主要用于火箭工程液体助燃剂,其分子的空间构型为___________ ,该分子为___________ (填“极性”或“非极性”)分子。
(4)三种卤化物 、
、 、
、 的熔点由高到低的顺序是
的熔点由高到低的顺序是___________ 。
(5) 在
在 的催化下,可与
的催化下,可与 反应得到
反应得到 。比较酸性强弱:
。比较酸性强弱:
___________  填“>”或“<”)。
填“>”或“<”)。
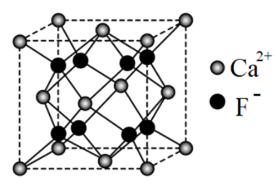
(6)萤石是自然界中常见的含氟矿物,其主要成分晶体的一种立方晶胞结构如图所示。该晶胞的化学式应为___________ 。若该立方晶胞的密度为 ,氟化钙的摩尔质量为
,氟化钙的摩尔质量为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞边长为
,则晶胞边长为___________ 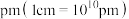 。
。
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为(2)四氟乙烯(
 )分子中,
)分子中, 键与
键与 键的数目比为
键的数目比为(3)
 主要用于火箭工程液体助燃剂,其分子的空间构型为
主要用于火箭工程液体助燃剂,其分子的空间构型为(4)三种卤化物
 、
、 、
、 的熔点由高到低的顺序是
的熔点由高到低的顺序是(5)
 在
在 的催化下,可与
的催化下,可与 反应得到
反应得到 。比较酸性强弱:
。比较酸性强弱:
 填“>”或“<”)。
填“>”或“<”)。(6)萤石是自然界中常见的含氟矿物,其主要成分晶体的一种立方晶胞结构如图所示。该晶胞的化学式应为
 ,氟化钙的摩尔质量为
,氟化钙的摩尔质量为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞边长为
,则晶胞边长为 。
。
您最近一年使用:0次
7 . 在催化剂作用下,环己酮氧化反应的可能机理如图所示。下列说法正确的是
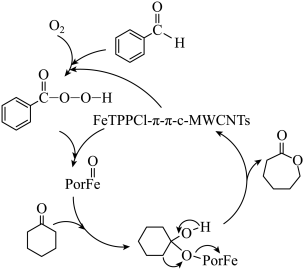

| A.产物中环上O原子的VSEPR模型为角形 |
B.用 代替环己酮所得产物为 代替环己酮所得产物为 |
C.每消耗 环己酮,转移电子数为 环己酮,转移电子数为 |
| D.用丙酮代替环己酮所得产物为乙酸甲酯 |
您最近一年使用:0次
名校
8 . 海洋资源的利用具有广阔的前景,从海水中提取镁的简单流程如下所示,下列说法正确的是
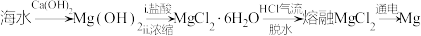
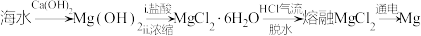
A.离子半径: |
B. 和 和 的VSEPR模型不同 的VSEPR模型不同 |
| C.1个Cl只能与1个H结合形成HCl是因为共价键具有饱和性 |
D. 、 、 、 、 均为含有极性共价键的离子晶体 均为含有极性共价键的离子晶体 |
您最近一年使用:0次
9 .  及其三聚体环状结构如图所示。下列说法
及其三聚体环状结构如图所示。下列说法不正确 的是
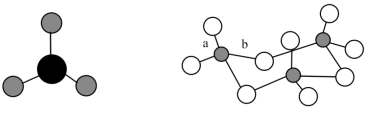
 及其三聚体环状结构如图所示。下列说法
及其三聚体环状结构如图所示。下列说法
A. 与 与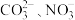 互为等电子体,空间结构都为平面三角形 互为等电子体,空间结构都为平面三角形 |
B. 为非极性分子,中心原子杂化类型 为非极性分子,中心原子杂化类型 |
| C.三聚体环状结构中S与O形成的共价键的键长有a、b两类 |
| D.该三聚体环状结构中含有12个σ键 |
您最近一年使用:0次
解题方法
10 . 含硅化合物在生活中的应用非常广泛。请回答下列问题:
(1)祖母绿宝石的主要成分化学式为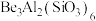 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
___________  。
。
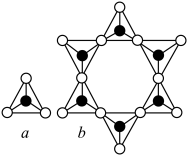
(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是___________ (不能用最简式表示)。
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与 在300℃反应生成
在300℃反应生成 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为___________ , 的空间构型为
的空间构型为___________ 。
(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是___________ 。
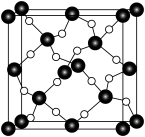
(5)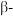 石英是晶质石英(
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为___________ ,请用价层电子对互斥模型解释图中键角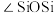 并不是
并不是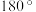 的原因是
的原因是___________ 。
(1)祖母绿宝石的主要成分化学式为
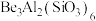 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
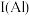 。
。(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为
 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与
 在300℃反应生成
在300℃反应生成 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为 的空间构型为
的空间构型为(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是
 |  | 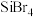 |  | |
| 沸点/K | 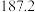 | 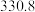 | 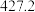 | 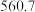 |
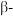 石英是晶质石英(
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为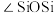 并不是
并不是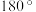 的原因是
的原因是
您最近一年使用:0次



