亚硫酸盐是一类很早即在世界范围内广泛使用的食品添加剂,可作为食品漂白剂,防腐剂;可抑制非酶褐变和酶促褐变,防止食品褐变,使水果不至黑变,还能防止鲜虾生成黑斑;在酸性介质中,还是十分有效的抗菌剂。
(1)亚硫酸钠中,阴离子的空间结构为___________ 。
(2)常温下, 溶液呈碱性,原因是
溶液呈碱性,原因是___________ (用离子方程式表示)。
(3)常温下,已知 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
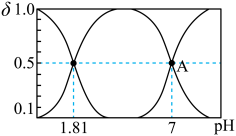
①A点溶液中离子浓度大小关系为___________ 。
②常温下, 溶液呈
溶液呈___________ 性,原因是___________ 。
(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是___________ (用离子方程式表示)。常温处理后,再调节 使
使 浓度不高于
浓度不高于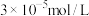 即可排放,调节
即可排放,调节 应不低于
应不低于___________ 。[已知Ksp[Cr(OH)3]=3×10-32]
(1)亚硫酸钠中,阴离子的空间结构为
(2)常温下,
 溶液呈碱性,原因是
溶液呈碱性,原因是(3)常温下,已知
 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
①A点溶液中离子浓度大小关系为
②常温下,
 溶液呈
溶液呈(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性
 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是 使
使 浓度不高于
浓度不高于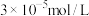 即可排放,调节
即可排放,调节 应不低于
应不低于
更新时间:2024-02-18 21:10:52
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】化合物 (
(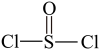 )是一种液态化合物,沸点77 ℃,在盛有
)是一种液态化合物,沸点77 ℃,在盛有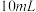 水的锥形瓶中小心地滴加8~10滴
水的锥形瓶中小心地滴加8~10滴 ,可观察到反应剧烈,液面上有白雾形成,并逸出有气味的气体,该气体可使沾有品红试液的滤纸褪色。轻轻振荡锥形瓶,待白雾消失后往溶液中滴加
,可观察到反应剧烈,液面上有白雾形成,并逸出有气味的气体,该气体可使沾有品红试液的滤纸褪色。轻轻振荡锥形瓶,待白雾消失后往溶液中滴加 溶液,有不溶于稀硝酸的白色沉淀析出。
溶液,有不溶于稀硝酸的白色沉淀析出。
(1)根据以上实验,写出 与水反应的化学方程式:
与水反应的化学方程式:_____________________________________ 。
(2)蒸干 溶液得不到
溶液得不到 固体,只能得到
固体,只能得到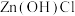 ,所以工业上往往用
,所以工业上往往用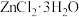 和
和 混合后共热来制取无水
混合后共热来制取无水 。
。
①写出蒸干 溶液过程中发生的化学反应方程式
溶液过程中发生的化学反应方程式__________________________________________________ 。
②写出该种制法可行性的原因:_______________________________________________ ,_______________________________________________________________________ 。(至少写出两个原因)。
 (
(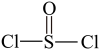 )是一种液态化合物,沸点77 ℃,在盛有
)是一种液态化合物,沸点77 ℃,在盛有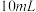 水的锥形瓶中小心地滴加8~10滴
水的锥形瓶中小心地滴加8~10滴 ,可观察到反应剧烈,液面上有白雾形成,并逸出有气味的气体,该气体可使沾有品红试液的滤纸褪色。轻轻振荡锥形瓶,待白雾消失后往溶液中滴加
,可观察到反应剧烈,液面上有白雾形成,并逸出有气味的气体,该气体可使沾有品红试液的滤纸褪色。轻轻振荡锥形瓶,待白雾消失后往溶液中滴加 溶液,有不溶于稀硝酸的白色沉淀析出。
溶液,有不溶于稀硝酸的白色沉淀析出。(1)根据以上实验,写出
 与水反应的化学方程式:
与水反应的化学方程式:(2)蒸干
 溶液得不到
溶液得不到 固体,只能得到
固体,只能得到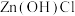 ,所以工业上往往用
,所以工业上往往用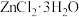 和
和 混合后共热来制取无水
混合后共热来制取无水 。
。①写出蒸干
 溶液过程中发生的化学反应方程式
溶液过程中发生的化学反应方程式②写出该种制法可行性的原因:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】肼(N2H4),又称为联氨,溶于水呈碱性,类似于氨气,已知N2H4在水溶液中的电离方程式:N2H4+H2O⇌ +OH-,
+OH-, +H2O⇌
+H2O⇌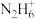 +OH-。常温下,将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中pOH[pOH=-lgc(OH-) ]随离子浓度变化的关系如图所示。
+OH-。常温下,将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中pOH[pOH=-lgc(OH-) ]随离子浓度变化的关系如图所示。
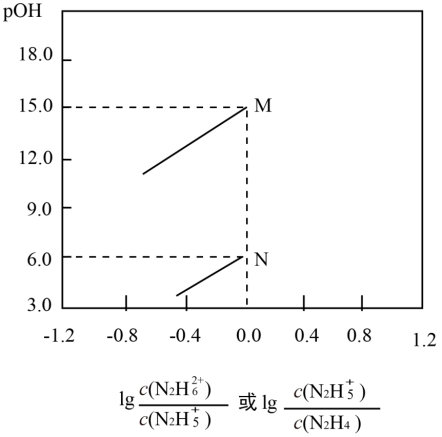
(1)表示pH与 的变化关系
的变化关系____ (M 或N)。
(2) 水解方程式为
水解方程式为__________________ 。
(3) N2H5Cl的水溶液呈_________ (“酸性”、“碱性”、“中性”)。
(4)反应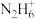 + N2H4⇌2
+ N2H4⇌2 的平衡常数K=
的平衡常数K=___________ 。
 +OH-,
+OH-, +H2O⇌
+H2O⇌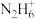 +OH-。常温下,将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中pOH[pOH=-lgc(OH-) ]随离子浓度变化的关系如图所示。
+OH-。常温下,将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中pOH[pOH=-lgc(OH-) ]随离子浓度变化的关系如图所示。
(1)表示pH与
 的变化关系
的变化关系(2)
 水解方程式为
水解方程式为(3) N2H5Cl的水溶液呈
(4)反应
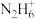 + N2H4⇌2
+ N2H4⇌2 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】在室温下,下列五种溶液,请根据要求填写下列空白:
①0.1mol∙L-1NH4Cl溶液;②0.1mol∙L-1CH3COONH4溶液;③0.1mol∙L-1NH4HSO4溶液;④0.1mol∙L-1 NH3∙H2O和0.1mol∙L-1NH4Cl混合液;⑤0.1mol∙L-1氨水
(1)溶液①呈_______ (填“酸”、“碱”或“中”)性,其原因是_______ (用离子方程式表示)。
(2)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度_______ (填“>”、“<”或“=”,下同) 的水解程度,CH3COO-与
的水解程度,CH3COO-与 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-)_______ c( )。
)。
(3)在溶液④中_______ (填离子符号)的浓度为0.1mol∙L-1;NH3∙H2O和_______ (填离子符号)的浓度之和为0.2mol∙L-1。
(4)溶液①至⑤中,c( )从大到小的顺序是
)从大到小的顺序是_______ 。
(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:_______ 。
②若溶液M由10mL2mol∙L-1NaHA溶液与10mL2mol∙L-1NaOH溶液混合而得,则溶液M的pH_______ (填“>”、“<”或“=”)7。
①0.1mol∙L-1NH4Cl溶液;②0.1mol∙L-1CH3COONH4溶液;③0.1mol∙L-1NH4HSO4溶液;④0.1mol∙L-1 NH3∙H2O和0.1mol∙L-1NH4Cl混合液;⑤0.1mol∙L-1氨水
(1)溶液①呈
(2)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度
 的水解程度,CH3COO-与
的水解程度,CH3COO-与 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-) )。
)。(3)在溶液④中
(4)溶液①至⑤中,c(
 )从大到小的顺序是
)从大到小的顺序是(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:
②若溶液M由10mL2mol∙L-1NaHA溶液与10mL2mol∙L-1NaOH溶液混合而得,则溶液M的pH
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】亚硝酸钠( )是一种重要的化工原料。亚硝酸钠易潮解,易溶于水和液氨,微溶于乙醇、甲醇、乙醚等有机溶剂。
)是一种重要的化工原料。亚硝酸钠易潮解,易溶于水和液氨,微溶于乙醇、甲醇、乙醚等有机溶剂。 时,用
时,用 试纸测得
试纸测得 溶液的
溶液的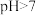 。
。
(1) 溶液
溶液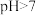 的原因是(用离子方程式表示)
的原因是(用离子方程式表示)_______ ,该 溶液中
溶液中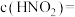
_______ (用溶液中其他离子的浓度关系式表示)。
(2)常温下,将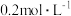 的
的 溶液和
溶液和 的
的 溶液等体积混合,所得溶液的
溶液等体积混合,所得溶液的 ,说明
,说明 的电离程度
的电离程度_______ (填“大于”或“小于”) 的水解程度。该混合溶液中离子浓度由大到小的顺序是
的水解程度。该混合溶液中离子浓度由大到小的顺序是_______ 。
(3)常温下, 的
的 溶液和
溶液和 的
的 溶液等体积混合后溶液
溶液等体积混合后溶液
_______ (填“大于”“小于”或“等于”,下同)7,
_______ 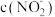 。
。
 )是一种重要的化工原料。亚硝酸钠易潮解,易溶于水和液氨,微溶于乙醇、甲醇、乙醚等有机溶剂。
)是一种重要的化工原料。亚硝酸钠易潮解,易溶于水和液氨,微溶于乙醇、甲醇、乙醚等有机溶剂。 时,用
时,用 试纸测得
试纸测得 溶液的
溶液的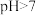 。
。(1)
 溶液
溶液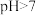 的原因是(用离子方程式表示)
的原因是(用离子方程式表示) 溶液中
溶液中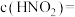
(2)常温下,将
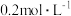 的
的 溶液和
溶液和 的
的 溶液等体积混合,所得溶液的
溶液等体积混合,所得溶液的 ,说明
,说明 的电离程度
的电离程度 的水解程度。该混合溶液中离子浓度由大到小的顺序是
的水解程度。该混合溶液中离子浓度由大到小的顺序是(3)常温下,
 的
的 溶液和
溶液和 的
的 溶液等体积混合后溶液
溶液等体积混合后溶液

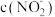 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,二盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
(1)写出二盐酸肼第一步水解反应的离子方程式_____________________ 。
(2)二盐酸肼水溶液中离子浓度的排列顺序正确的是_____ 。
A.c(Cl﹣)>c(N2H62+)>c(H+)>c(OH﹣);
B.c(Cl﹣)>c([N2H5•H2O]+)>c(H+)>c(OH﹣);
C.c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(Cl﹣)+c(OH﹣);
D.c(N2H62+)>c(Cl﹣)>c(H+)>c(OH﹣);
Ⅱ.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA﹣;HA⇌H++A2﹣则NaHA溶液显_____ (填“酸性”,“中性”,或“碱性”),理由是___________________ ;
Ⅲ.已知HClO的Ka为3.0×10﹣8,H2CO3的 Ka1=4.31×10﹣7 Ka2=5.61×10﹣11,写出向次氯酸钠中通入少量二氧化碳的离子反应方程式:____________________ 。
(1)写出二盐酸肼第一步水解反应的离子方程式
(2)二盐酸肼水溶液中离子浓度的排列顺序正确的是
A.c(Cl﹣)>c(N2H62+)>c(H+)>c(OH﹣);
B.c(Cl﹣)>c([N2H5•H2O]+)>c(H+)>c(OH﹣);
C.c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(Cl﹣)+c(OH﹣);
D.c(N2H62+)>c(Cl﹣)>c(H+)>c(OH﹣);
Ⅱ.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA﹣;HA⇌H++A2﹣则NaHA溶液显
Ⅲ.已知HClO的Ka为3.0×10﹣8,H2CO3的 Ka1=4.31×10﹣7 Ka2=5.61×10﹣11,写出向次氯酸钠中通入少量二氧化碳的离子反应方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】研究电解质在水溶液中的平衡能了解它的存在形式。
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)物质的量浓度均为 的下列四种溶液:
的下列四种溶液: 由小到大排列的顺序是___________。
由小到大排列的顺序是___________。
(2)常温下, 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是___________ (填序号)。
A. B.
B. C.
C.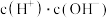 D.
D. E.
E.
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(4)25℃时,将 的醋酸溶液与
的醋酸溶液与 氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
___________ (用含a、b的代数式表示)。
(5)标准状况下将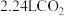 ,通入
,通入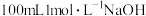 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式: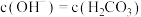 +
+___________ 。
(6)25℃,氨水的浓度为 ,溶液中的
,溶液中的
___________  。将
。将 通入该氨水中,当溶液中
通入该氨水中,当溶液中 降至
降至 时,溶液中
时,溶液中
___________  。(填“">”或“<”或“=”)
。(填“">”或“<”或“=”)
(7)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 类似。
类似。
①写出盐酸肼第一步水解反应的离子方程式___________ 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是___________ (填序号)。
A.
B.
C.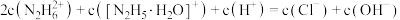
D.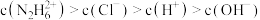
(8)常温下,要将 溶液中的
溶液中的 沉淀完全(Zn2+的浓度小于10-5mol/L),应控制溶液的
沉淀完全(Zn2+的浓度小于10-5mol/L),应控制溶液的 大于
大于___________ 。(已知25℃时,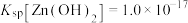 )
)
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 |  |  |  |  |
| 电离平衡常数 |  | 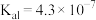  | 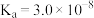 | 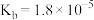 |
 的下列四种溶液:
的下列四种溶液: 由小到大排列的顺序是___________。
由小到大排列的顺序是___________。A. | B. | C. | D. |
 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是A.
 B.
B. C.
C.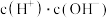 D.
D. E.
E.
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(4)25℃时,将
 的醋酸溶液与
的醋酸溶液与 氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
(5)标准状况下将
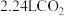 ,通入
,通入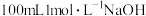 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式: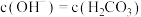 +
+(6)25℃,氨水的浓度为
 ,溶液中的
,溶液中的
 。将
。将 通入该氨水中,当溶液中
通入该氨水中,当溶液中 降至
降至 时,溶液中
时,溶液中
 。(填“">”或“<”或“=”)
。(填“">”或“<”或“=”)(7)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与
 类似。
类似。①写出盐酸肼第一步水解反应的离子方程式
②盐酸肼水溶液中离子浓度的排列顺序正确的是
A.

B.

C.
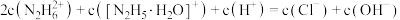
D.
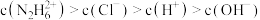
(8)常温下,要将
 溶液中的
溶液中的 沉淀完全(Zn2+的浓度小于10-5mol/L),应控制溶液的
沉淀完全(Zn2+的浓度小于10-5mol/L),应控制溶液的 大于
大于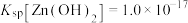 )
)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】2011年8月12日,《云南信息报》首度披露了云南曲靖铬污染事件,引起全国广泛关注。工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为:SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌:+3价铬不易被人体吸收,毒性小。
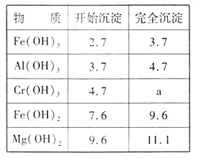
③右表为一些金属氢氧化物沉淀的pH参照数据。
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4·7H2O),加入绿矾的目的是__________ 。
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是_______ ;常温下,Cr(OH)3的溶度积Ksp=1×10-32,要使Cr3+完全沉淀[c(Cr3+)降至1×10-5mol·L-1视为沉淀完全],溶液的pH应调于a=___________ 。
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含__________ 溶质的溶液。

已知:①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌:+3价铬不易被人体吸收,毒性小。
③右表为一些金属氢氧化物沉淀的pH参照数据。
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4·7H2O),加入绿矾的目的是
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知下列物质在20 ℃时的Ksp见下表,试回答下列问题:
(1)20 ℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是___________ 。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
=___________ 。
(3)测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是___________(填字母)。
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 砖红色 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 | 2.0×10-48 | 2.0×10-12 |
(1)20 ℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
 =
=(3)测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是___________(填字母)。
| A.KBr | B.KI |
| C.K2S | D.K2CrO4 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式为Ksp=___________ 。
(2)一定温度下,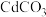 的
的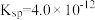 ,
, 的
的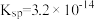 ,那么它们在水中的溶解量
,那么它们在水中的溶解量___________ 较大。
(3)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到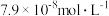 时,废水中
时,废水中 的浓度为
的浓度为___________ mol/L[已知: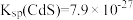 ,
,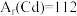 ],此时是否符合生活饮用水卫生标准?
],此时是否符合生活饮用水卫生标准?___________ (填“是”或“否”)。
Ⅱ.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,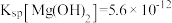 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,向 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为___________ 。
(5)25℃向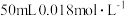 的
的 溶液中加入
溶液中加入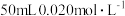 的盐酸,生成沉淀。已知该温度下,AgCl的
的盐酸,生成沉淀。已知该温度下,AgCl的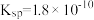 ,忽略溶液的体积变化,请计算:
,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中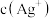 =
=___________ ,
②完全沉淀后,溶液的pH=___________ 。
③如果向完全沉淀后的溶液中继续加入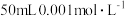 的盐酸,是否有白色沉淀生成?
的盐酸,是否有白色沉淀生成?___________ (填“是”或“否”)。
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式为Ksp=
(2)一定温度下,
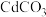 的
的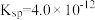 ,
, 的
的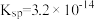 ,那么它们在水中的溶解量
,那么它们在水中的溶解量(3)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到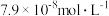 时,废水中
时,废水中 的浓度为
的浓度为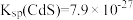 ,
,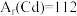 ],此时是否符合生活饮用水卫生标准?
],此时是否符合生活饮用水卫生标准?Ⅱ.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,
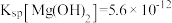 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下: |  | 8.0~96 | 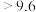 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为(5)25℃向
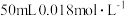 的
的 溶液中加入
溶液中加入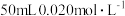 的盐酸,生成沉淀。已知该温度下,AgCl的
的盐酸,生成沉淀。已知该温度下,AgCl的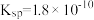 ,忽略溶液的体积变化,请计算:
,忽略溶液的体积变化,请计算:①完全沉淀后,溶液中
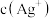 =
=②完全沉淀后,溶液的pH=
③如果向完全沉淀后的溶液中继续加入
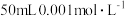 的盐酸,是否有白色沉淀生成?
的盐酸,是否有白色沉淀生成?
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】黄铁矿是制取硫酸的主要原料,其主要成分为FeS2,其中铁元素显+2价,FeS2晶体的晶胞形状为立方体,晶胞结构如图所示。

(1)基态Fe2+的价电子排布式是___________ 。
(2)制取硫酸过程中会产生SO3,SO3分子的空间构型为___________ 。
(3)晶胞中与每个S 距离最近且相等的Fe2+有
距离最近且相等的Fe2+有___________ 个。
(4)FeS2晶体的晶胞边长为anm,FeS2的摩尔质量为120g·mol-1,阿伏加德罗常数的值为NA,该FeS2晶体的密度ρ=___________ g·cm-3(1nm=10-7cm,用含a、NA的代数式表示)

(1)基态Fe2+的价电子排布式是
(2)制取硫酸过程中会产生SO3,SO3分子的空间构型为
(3)晶胞中与每个S
 距离最近且相等的Fe2+有
距离最近且相等的Fe2+有(4)FeS2晶体的晶胞边长为anm,FeS2的摩尔质量为120g·mol-1,阿伏加德罗常数的值为NA,该FeS2晶体的密度ρ=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】铜及其化合物在工农业生产中有广泛的应用。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有___________(填字母)。
(2)将CuO投入NH3、(NH4)2SO4的混合溶液中进行“氨浸”,控制温度为50℃至55℃,pH约为9.5,CuO转化为溶液。
①CuO被浸取的离子方程式为___________ 。
②[Cu(NH3)4]2+结构中,若用两个H2O分子代替两个NH3分子,可以得到两种不同结构的化合物,由此推测的[Cu(NH3)4]2+空间构型为___________ 。
(3)Cu2+可以与乙二胺(H2N-CH2-CH2-NH2) 形成配离子,结构如图所示:
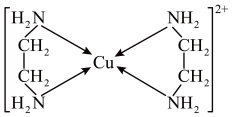
乙二胺分子中N原子成键时采取的VSEPR模型是___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因是___________ 。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有___________(填字母)。
| A.离子键 | B.金属键 | C.极性共价键 | D.非极性共价键 |
①CuO被浸取的离子方程式为
②[Cu(NH3)4]2+结构中,若用两个H2O分子代替两个NH3分子,可以得到两种不同结构的化合物,由此推测的[Cu(NH3)4]2+空间构型为
(3)Cu2+可以与乙二胺(H2N-CH2-CH2-NH2) 形成配离子,结构如图所示:

乙二胺分子中N原子成键时采取的VSEPR模型是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1) 是有机合成中常用的还原剂,
是有机合成中常用的还原剂, 中的阴离子空间结构是
中的阴离子空间结构是______ ,中心原子的杂化形式为______ , 中存在
中存在______ 。
A.离子键 B. 键 C.
键 C. 键 D.氢键
键 D.氢键
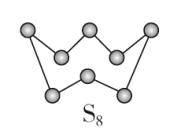
(2)根据价电子对互斥理论,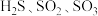 的气态分子中,中心原子价电子对数不同于其他分子的是
的气态分子中,中心原子价电子对数不同于其他分子的是______ 。下图为 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______ 。气态三氧化硫以单分子形式存在,其分子的空间结构为______ ,其中共价键的类型有______ 种。
(3)《中华本草》等中医典籍中,记载了炉甘石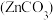 入药,可用于治疗皮肤炎症或表面创伤。
入药,可用于治疗皮肤炎症或表面创伤。
① 具有较高的熔点(872℃),其化学键类型是
具有较高的熔点(872℃),其化学键类型是______ ;
② 不溶于有机溶剂而
不溶于有机溶剂而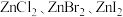 能够溶于乙醇、乙醚等有机溶剂,原因是
能够溶于乙醇、乙醚等有机溶剂,原因是______ 。
③ 中,阴离子空间结构为
中,阴离子空间结构为______ ,C原子的杂化形式为______ 。
 是有机合成中常用的还原剂,
是有机合成中常用的还原剂, 中的阴离子空间结构是
中的阴离子空间结构是 中存在
中存在A.离子键 B.
 键 C.
键 C. 键 D.氢键
键 D.氢键(2)根据价电子对互斥理论,
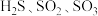 的气态分子中,中心原子价电子对数不同于其他分子的是
的气态分子中,中心原子价电子对数不同于其他分子的是 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
(3)《中华本草》等中医典籍中,记载了炉甘石
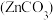 入药,可用于治疗皮肤炎症或表面创伤。
入药,可用于治疗皮肤炎症或表面创伤。①
 具有较高的熔点(872℃),其化学键类型是
具有较高的熔点(872℃),其化学键类型是②
 不溶于有机溶剂而
不溶于有机溶剂而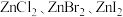 能够溶于乙醇、乙醚等有机溶剂,原因是
能够溶于乙醇、乙醚等有机溶剂,原因是③
 中,阴离子空间结构为
中,阴离子空间结构为
您最近一年使用:0次



