解题方法
1 . 2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:
(1)画出基态碳原子的价层电子排布图___________ 。
(2)图A、B、C分别表示基态C、N、O和F原子的原子半径、第一电离能和电负性的变化趋势(纵坐标的标度不同)。
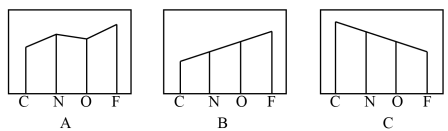
表示原子半径的变化图是___________ (填序号,下同),表示电负性的变化图是___________ 。表示第一电离能的变化图是___________ ,判断第一电离能变化图的根据是___________ 。
(3) 和
和 分子中C原子的杂化轨道类型分别为
分子中C原子的杂化轨道类型分别为___________ 和___________ 。
(4)甲烷与氯气光照发生取代反应能生成多种有机物,其中一氯甲烷(CH3Cl)的价层电子对互斥模型是___________ 形,从分子构型上分析二氯甲烷(CH2Cl2)存在___________ 种分子。
(5)Cu、Al等金属具有良好的导电性,从金属键的角度分析,原因是___________ 。
(6) 的一种晶体与NaCl晶体的结构相似,该
的一种晶体与NaCl晶体的结构相似,该 晶体的一个晶胞中
晶体的一个晶胞中 的数目为
的数目为___________ ,与 相邻的最近的
相邻的最近的 个数
个数___________ 。若晶胞参数为apm,阿伏加德罗常数的值为 ,
, 的摩尔质量为Mg/mol,则该晶体的密度为
的摩尔质量为Mg/mol,则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)画出基态碳原子的价层电子排布图
(2)图A、B、C分别表示基态C、N、O和F原子的原子半径、第一电离能和电负性的变化趋势(纵坐标的标度不同)。

表示原子半径的变化图是
(3)
 和
和 分子中C原子的杂化轨道类型分别为
分子中C原子的杂化轨道类型分别为(4)甲烷与氯气光照发生取代反应能生成多种有机物,其中一氯甲烷(CH3Cl)的价层电子对互斥模型是
(5)Cu、Al等金属具有良好的导电性,从金属键的角度分析,原因是
(6)
 的一种晶体与NaCl晶体的结构相似,该
的一种晶体与NaCl晶体的结构相似,该 晶体的一个晶胞中
晶体的一个晶胞中 的数目为
的数目为 相邻的最近的
相邻的最近的 个数
个数 ,
, 的摩尔质量为Mg/mol,则该晶体的密度为
的摩尔质量为Mg/mol,则该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解题方法
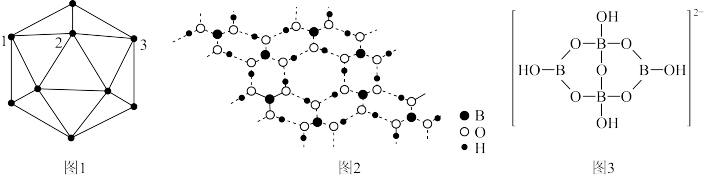
2 . 单质硼、硼酸(H3BO3)、硼砂(Na2B4O7·10H2O)中阴离子(H4B4O92-)的结构或结构单元分别如图1、图2、图3所示。
(1)图1为某晶体硼的部分结构单元,该结构单元由20个等边三角形构成,则构成此结构单元的B原子数为_______ ,图中标记1、2、3的3个B原子形成的夹角为_______ 。
(2)已知H3BO3与NaOH溶液反应时,当NaOH过量时,发生反应的化学方程式为 ,当H3BO3过量时,发生反应的化学方程式为
,当H3BO3过量时,发生反应的化学方程式为 ,则H3BO3是
,则H3BO3是_______ 元弱酸,硼酸晶体中存在的作用力有_______ (填标号)。
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(3)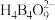 中得电子的原子是
中得电子的原子是_______ (填元素符号),结构中B原子的杂化方式为_______ 。
(4)B、Al,Ga为同主族元素,AlCl3,GaCl3在一定条件下均易形成双聚分子,而BCl3却很难形成双聚分子,其主要原因是BCl3分子内形成了大π键,该大π键可表示为_______ 。(分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数)
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数)
(1)图1为某晶体硼的部分结构单元,该结构单元由20个等边三角形构成,则构成此结构单元的B原子数为
(2)已知H3BO3与NaOH溶液反应时,当NaOH过量时,发生反应的化学方程式为
 ,当H3BO3过量时,发生反应的化学方程式为
,当H3BO3过量时,发生反应的化学方程式为 ,则H3BO3是
,则H3BO3是a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(3)
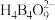 中得电子的原子是
中得电子的原子是(4)B、Al,Ga为同主族元素,AlCl3,GaCl3在一定条件下均易形成双聚分子,而BCl3却很难形成双聚分子,其主要原因是BCl3分子内形成了大π键,该大π键可表示为
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数)
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数)
您最近一年使用:0次
2022-07-03更新
|
146次组卷
|
2卷引用:河北省保定市2021-2022学年高二下学期期末考试化学试题
解题方法
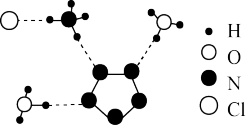
3 . 我国科学家最近成功合成了世界上首个五氮阴离子盐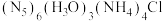 (用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知
(用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知 是平面结构)。下列说法不正确的是
是平面结构)。下列说法不正确的是
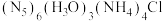 (用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知
(用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知 是平面结构)。下列说法不正确的是
是平面结构)。下列说法不正确的是
| A.化合物R中存在极性键和非极性键 |
| B.化合物R中存在氢键 |
C. 中氧原子采取 中氧原子采取 杂化, 杂化, 中氮原子采取 中氮原子采取 杂化 杂化 |
D.阴离子 中氮原子是 中氮原子是 杂化 杂化 |
您最近一年使用:0次
2022-06-30更新
|
397次组卷
|
3卷引用:河北省沧州市2021-2022学年高二下学期期末考试化学试题
名校
解题方法
4 . 氧族元素是元素周期表中第VIA族元素,包含氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)五种元素,它们及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为____ 。
(2)H2O、H2S、H2Se、H2Te的沸点由高到低的顺序为____ ,原因是____ 。
(3)SO 与SO
与SO 相比,键角较小的是
相比,键角较小的是___ (填离子符号),原因是____ 。
(4)依布硒是一种有机硒化物,具有良好的抗炎活性,其结构简式为 。依布硒分子中
。依布硒分子中 、C原子的杂化类型分别为
、C原子的杂化类型分别为____ 、____ 。
(5)国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)“发电玻璃”被誉为“挂在墙上的油田”。碲化镉立方晶胞结构如图。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知晶胞中A、B原子的分数坐标分别为A(0,0,0)、B( ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为____ 。
②碲化镉晶体的密度为ρg•cm-3,设NA为阿伏加德罗常数的值,则其晶胞边长为a=____ 。
(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为(2)H2O、H2S、H2Se、H2Te的沸点由高到低的顺序为
(3)SO
 与SO
与SO 相比,键角较小的是
相比,键角较小的是(4)依布硒是一种有机硒化物,具有良好的抗炎活性,其结构简式为
 。依布硒分子中
。依布硒分子中 、C原子的杂化类型分别为
、C原子的杂化类型分别为(5)国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)“发电玻璃”被誉为“挂在墙上的油田”。碲化镉立方晶胞结构如图。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知晶胞中A、B原子的分数坐标分别为A(0,0,0)、B(
 ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为②碲化镉晶体的密度为ρg•cm-3,设NA为阿伏加德罗常数的值,则其晶胞边长为a=
您最近一年使用:0次
2022-05-26更新
|
368次组卷
|
4卷引用:河北省沧衡八校联盟2021-2022学年高二下学期期中考试化学试题
河北省沧衡八校联盟2021-2022学年高二下学期期中考试化学试题河北省沧州市任丘第一中学2021-2022学年高二下学期阶段考试(二)化学试题四川省雅安中学2022-2023学年高二上学期期中考试化学试题(已下线)期中模拟预测卷03(测试范围:选择性必修2+选择性必修3第1-2章)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)
解题方法
5 . 碳、氮及其化合物广泛存在于自然界中,回答下列问题:
(1)科学家已证实,存在一种空心且类似于足球结构的物质N60,它可能成为一种很好的火箭燃料。固态N60的晶体类型为_______ 。
(2)氰酸是一种无机物,化学式为HCNO,是一种具有挥发性和腐蚀性的液体,高毒。HCNO的组成元素中第一电离能最小的是_______ (填元素符号,下同),电负性最大的是_______ 。
(3)镍能形成多种配合物,如正四面体形的Ni(CO)4,、正方形的 和正八面体形的
和正八面体形的 。下列说法不正确的是
。下列说法不正确的是_______ (填标号)。
A. CO分子内σ键和π键的数目之比为1:2
B. NH3的空间构型为平面三角形
C. Ni2+在形成配合物时,其配位数可能为4或6
D. Ni(CO)4和 中,镍元素均是sp3杂化
中,镍元素均是sp3杂化
(4)化合物(CH3)3N能溶于水,其原因是_______ ,(CH3)3N与盐酸反应生成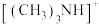 ,
,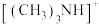 中新生成的化学键的类型为
中新生成的化学键的类型为_______ 。
(5)阳离子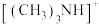 和阴离子A按个数比4:1组成化合物,阴离子A的结构如图所示,则S原子的杂化轨道类型是
和阴离子A按个数比4:1组成化合物,阴离子A的结构如图所示,则S原子的杂化轨道类型是_______ ,阴离子A的化学式为_______ 。
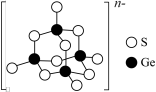
(6)某碳单质的晶胞结构如图所示,回答下列问题:

①该晶胞中含_______ 个C原子。
②将每个C原子视为一个球,若C原子的半径为R,1个C原子的体积为V,1个晶胞的体积为V0,堆积系数 ,则该晶体的堆积系数
,则该晶体的堆积系数
_______ (保留1位有效数字,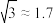 ,
, )。(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线的四等分点)
)。(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线的四等分点)
(1)科学家已证实,存在一种空心且类似于足球结构的物质N60,它可能成为一种很好的火箭燃料。固态N60的晶体类型为
(2)氰酸是一种无机物,化学式为HCNO,是一种具有挥发性和腐蚀性的液体,高毒。HCNO的组成元素中第一电离能最小的是
(3)镍能形成多种配合物,如正四面体形的Ni(CO)4,、正方形的
 和正八面体形的
和正八面体形的 。下列说法不正确的是
。下列说法不正确的是A. CO分子内σ键和π键的数目之比为1:2
B. NH3的空间构型为平面三角形
C. Ni2+在形成配合物时,其配位数可能为4或6
D. Ni(CO)4和
 中,镍元素均是sp3杂化
中,镍元素均是sp3杂化(4)化合物(CH3)3N能溶于水,其原因是
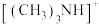 ,
,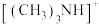 中新生成的化学键的类型为
中新生成的化学键的类型为(5)阳离子
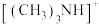 和阴离子A按个数比4:1组成化合物,阴离子A的结构如图所示,则S原子的杂化轨道类型是
和阴离子A按个数比4:1组成化合物,阴离子A的结构如图所示,则S原子的杂化轨道类型是
(6)某碳单质的晶胞结构如图所示,回答下列问题:

①该晶胞中含
②将每个C原子视为一个球,若C原子的半径为R,1个C原子的体积为V,1个晶胞的体积为V0,堆积系数
 ,则该晶体的堆积系数
,则该晶体的堆积系数
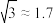 ,
, )。(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线的四等分点)
)。(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线的四等分点)
您最近一年使用:0次
2021-07-15更新
|
150次组卷
|
2卷引用:河北省部分名校2020-2021学年高二下学期期末联考化学试题
名校
6 . 南京理工大学化工学院胡炳成教授团队成功合成世界首个全氮阴离子盐,其局部结构如图所示。下列说法错误的是

A.经 射线衍射可以测得全氮阴离子盐晶体结构 射线衍射可以测得全氮阴离子盐晶体结构 |
| B.全氮阴离子盐两种阳离子中心原子的杂化轨道类型相同 |
C. 中所有的氮原子在同一平面内 中所有的氮原子在同一平面内 |
D. 的键角比全氮阴离子盐的两种阳离子键角都大 的键角比全氮阴离子盐的两种阳离子键角都大 |
您最近一年使用:0次
2021-07-07更新
|
763次组卷
|
3卷引用:河北省秦皇岛市第一中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
7 . “嫦娥五号”首次实现了我国地外天体采样返回,它的成功发射标志着我国航天向前迈出了一大步。其制作材料中包含了Ti、Fe、Al、Cr、Ni、Mo、S、O等多种元素。回答下列问题:
(1)铬(Cr)基态时原子的核外电子排布式为___________________ ;基态Cr3+最高能层中成对电子与单电子的数目比为__________________________ 。
(2)S与O可形成多种酸根离子,其中 的空间构型为
的空间构型为_____________________ ,S原子的杂化轨道类型为_______________ ,其键角小于 的原因为
的原因为___________________________________________ 。
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀(如图),该反应可用于检验Ni2+。丁二酮肟镍中存在的化学键有____________ (填标号)。
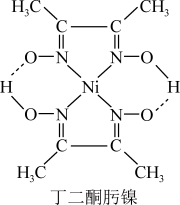
A.离子键 B. 配位键 C.氢键
D.金属键 E.范德华力 F.共价键
(4)α- Al2O3是“嫦娥五号”中用到的一种耐火材料, 其具有熔点高(2054°C)、硬度大的特点,其主要原因为____________________________________________________________________ 。
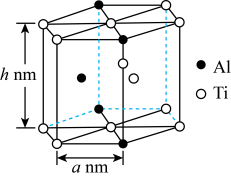
(5)“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),则该合金的化学式为____________________________ 。已知该合金的密度为ρg·cm-3,该结构单元底面(正六边形)边长为anm,则结构单元的高h为________________ nm(列出计算式,设NA为阿伏加德罗常数的值)。
(1)铬(Cr)基态时原子的核外电子排布式为
(2)S与O可形成多种酸根离子,其中
 的空间构型为
的空间构型为 的原因为
的原因为(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀(如图),该反应可用于检验Ni2+。丁二酮肟镍中存在的化学键有

A.离子键 B. 配位键 C.氢键
D.金属键 E.范德华力 F.共价键
(4)α- Al2O3是“嫦娥五号”中用到的一种耐火材料, 其具有熔点高(2054°C)、硬度大的特点,其主要原因为
(5)“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),则该合金的化学式为

您最近一年使用:0次
名校
8 . Ⅰ.(多选)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是( )
A.SiX4难水解B.SiX4是共价化合物
C.NaX易水解D.NaX的熔点一般高于SiX4
Ⅱ.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60和碳纳米管等都是碳元素的单质形式,它们互为________ 。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________ 、________ 。
(3)C60属于________ 晶体,石墨属于________ 晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C—C间的________ 共价键,而石墨层内的C—C间不仅存在________ 共价键,还有________ 键。
(5)金刚石晶胞含有________ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=________ a,列式表示碳原子在晶胞中的空间占有率________ (不要求计算结果)。
A.SiX4难水解B.SiX4是共价化合物
C.NaX易水解D.NaX的熔点一般高于SiX4
Ⅱ.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60和碳纳米管等都是碳元素的单质形式,它们互为
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为
(3)C60属于
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C—C间的
(5)金刚石晶胞含有
您最近一年使用:0次
解题方法
9 . 铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为 1 。N、O、S三种元素的第一电离能大小顺序为 2 (填元素符号)。
②SO42-的空间构型为 3 ,与SO42-互为等电子体的有机分子的化学式为 4 。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因 5 ;在该晶体中存在的化学键的种类有 6 。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为 7 。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为 8 。

(4)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为 9 pm,求算阿伏加德罗常数的表达式为 10 。
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为
②SO42-的空间构型为
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为

(4)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为
您最近一年使用:0次



