解题方法
1 . 2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:
(1)画出基态碳原子的价层电子排布图___________ 。
(2)图A、B、C分别表示基态C、N、O和F原子的原子半径、第一电离能和电负性的变化趋势(纵坐标的标度不同)。
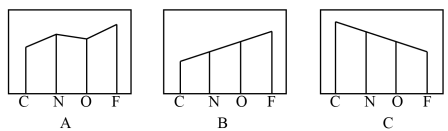
表示原子半径的变化图是___________ (填序号,下同),表示电负性的变化图是___________ 。表示第一电离能的变化图是___________ ,判断第一电离能变化图的根据是___________ 。
(3) 和
和 分子中C原子的杂化轨道类型分别为
分子中C原子的杂化轨道类型分别为___________ 和___________ 。
(4)甲烷与氯气光照发生取代反应能生成多种有机物,其中一氯甲烷(CH3Cl)的价层电子对互斥模型是___________ 形,从分子构型上分析二氯甲烷(CH2Cl2)存在___________ 种分子。
(5)Cu、Al等金属具有良好的导电性,从金属键的角度分析,原因是___________ 。
(6) 的一种晶体与NaCl晶体的结构相似,该
的一种晶体与NaCl晶体的结构相似,该 晶体的一个晶胞中
晶体的一个晶胞中 的数目为
的数目为___________ ,与 相邻的最近的
相邻的最近的 个数
个数___________ 。若晶胞参数为apm,阿伏加德罗常数的值为 ,
, 的摩尔质量为Mg/mol,则该晶体的密度为
的摩尔质量为Mg/mol,则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)画出基态碳原子的价层电子排布图
(2)图A、B、C分别表示基态C、N、O和F原子的原子半径、第一电离能和电负性的变化趋势(纵坐标的标度不同)。

表示原子半径的变化图是
(3)
 和
和 分子中C原子的杂化轨道类型分别为
分子中C原子的杂化轨道类型分别为(4)甲烷与氯气光照发生取代反应能生成多种有机物,其中一氯甲烷(CH3Cl)的价层电子对互斥模型是
(5)Cu、Al等金属具有良好的导电性,从金属键的角度分析,原因是
(6)
 的一种晶体与NaCl晶体的结构相似,该
的一种晶体与NaCl晶体的结构相似,该 晶体的一个晶胞中
晶体的一个晶胞中 的数目为
的数目为 相邻的最近的
相邻的最近的 个数
个数 ,
, 的摩尔质量为Mg/mol,则该晶体的密度为
的摩尔质量为Mg/mol,则该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2 . 吹沙填海是在填海点的周围用吹沙的方式堆沙造地。海水流出目标圈外,沙留在圈内,渐渐地圈内的海面就被不断吹进的沙填成了陆地,再用强夯机压实松土。高纯硅是现代信息、半导体和光伏发电等产业的基础材料。制备高纯硅的主要工艺流程如图所示:
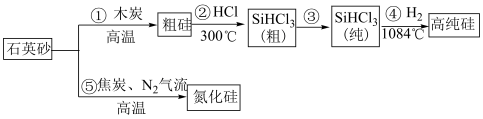
已知:SiHCl3极易水解,反应过程中会产生氢气。
回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒,SiO2的晶体类型为_____ ,其属于______ (填“酸性”或“碱性”)氧化物。化学上常用氧化物的形式表示硅酸盐的组成,例如青花瓷胎体的原料——高岭土[Al2Si2O5(OH)x]可表示为______ 。
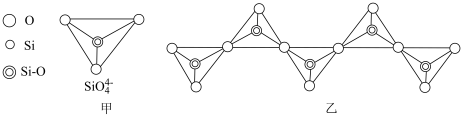
(2)在硅酸盐中,SiO 四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为
四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为______ ,该多硅酸根的最简式为______ 。
(3)工业上用纯净石英砂与C在高温下发生反应制造的粗硅中往往含有SiC,若粗硅中Si和SiC的物质的量之比为2∶1,则①的化学方程式为______ 。
(4)流程③提纯SiHCl3的操作名称为______ 。以上①~⑤的流程中,包含置换反应的是______ (填序号)。整个操作流程都需隔绝空气,原因是_______ 、______ (答出两条即可)。
(5)神舟十四号飞船成功发射标志着我国航天事业再上新台阶。氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为______ 。

已知:SiHCl3极易水解,反应过程中会产生氢气。
回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒,SiO2的晶体类型为
(2)在硅酸盐中,SiO
 四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为
四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为
(3)工业上用纯净石英砂与C在高温下发生反应制造的粗硅中往往含有SiC,若粗硅中Si和SiC的物质的量之比为2∶1,则①的化学方程式为
(4)流程③提纯SiHCl3的操作名称为
(5)神舟十四号飞船成功发射标志着我国航天事业再上新台阶。氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为
您最近一年使用:0次
真题
解题方法
3 . 含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为_____ 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是____ ,原因是_____ 。
(3)SnCl 的几何构型为
的几何构型为____ ,其中心离子杂化方式为____ 。
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是____ (填标号)。
(5)如图是硫的四种含氧酸根的结构:
A. B.
B. 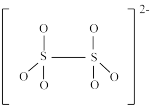 C.
C.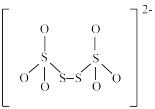 D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO 的是
的是____ (填标号),理由是____ 。
(6)如图是CZTS四元半导体化合物的四方晶胞。
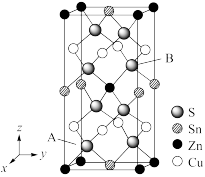
①该物质的化学式为_____ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( ,
, ,
, ),则B原子的坐标为
),则B原子的坐标为_____ 。
(1)基态S原子的价电子中,两种自旋状态的电子数之比为
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是
(3)SnCl
 的几何构型为
的几何构型为(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是
| A.[Cu(NH3)2]Cl | B.[Cu(NH3)4]SO4 | C.[Zn(NH3)4]SO4 | D.Na2[Zn(OH)4] |
A.
 B.
B.  C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO
 的是
的是(6)如图是CZTS四元半导体化合物的四方晶胞。

①该物质的化学式为
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为(
 ,
, ,
, ),则B原子的坐标为
),则B原子的坐标为
您最近一年使用:0次
解题方法
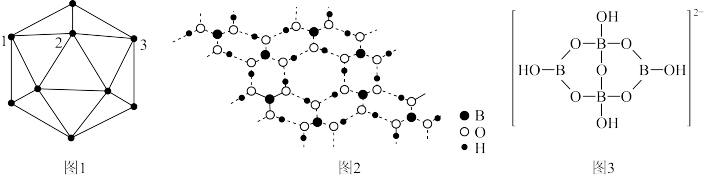
4 . 单质硼、硼酸(H3BO3)、硼砂(Na2B4O7·10H2O)中阴离子(H4B4O92-)的结构或结构单元分别如图1、图2、图3所示。
(1)图1为某晶体硼的部分结构单元,该结构单元由20个等边三角形构成,则构成此结构单元的B原子数为_______ ,图中标记1、2、3的3个B原子形成的夹角为_______ 。
(2)已知H3BO3与NaOH溶液反应时,当NaOH过量时,发生反应的化学方程式为 ,当H3BO3过量时,发生反应的化学方程式为
,当H3BO3过量时,发生反应的化学方程式为 ,则H3BO3是
,则H3BO3是_______ 元弱酸,硼酸晶体中存在的作用力有_______ (填标号)。
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(3)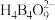 中得电子的原子是
中得电子的原子是_______ (填元素符号),结构中B原子的杂化方式为_______ 。
(4)B、Al,Ga为同主族元素,AlCl3,GaCl3在一定条件下均易形成双聚分子,而BCl3却很难形成双聚分子,其主要原因是BCl3分子内形成了大π键,该大π键可表示为_______ 。(分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数)
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数)
(1)图1为某晶体硼的部分结构单元,该结构单元由20个等边三角形构成,则构成此结构单元的B原子数为
(2)已知H3BO3与NaOH溶液反应时,当NaOH过量时,发生反应的化学方程式为
 ,当H3BO3过量时,发生反应的化学方程式为
,当H3BO3过量时,发生反应的化学方程式为 ,则H3BO3是
,则H3BO3是a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(3)
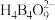 中得电子的原子是
中得电子的原子是(4)B、Al,Ga为同主族元素,AlCl3,GaCl3在一定条件下均易形成双聚分子,而BCl3却很难形成双聚分子,其主要原因是BCl3分子内形成了大π键,该大π键可表示为
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数)
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数)
您最近一年使用:0次
2022-07-03更新
|
140次组卷
|
2卷引用:河北省保定市2021-2022学年高二下学期期末考试化学试题
解题方法
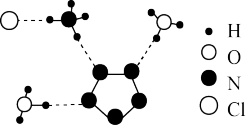
5 . 我国科学家最近成功合成了世界上首个五氮阴离子盐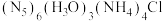 (用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知
(用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知 是平面结构)。下列说法不正确的是
是平面结构)。下列说法不正确的是
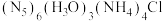 (用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知
(用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知 是平面结构)。下列说法不正确的是
是平面结构)。下列说法不正确的是
| A.化合物R中存在极性键和非极性键 |
| B.化合物R中存在氢键 |
C. 中氧原子采取 中氧原子采取 杂化, 杂化, 中氮原子采取 中氮原子采取 杂化 杂化 |
D.阴离子 中氮原子是 中氮原子是 杂化 杂化 |
您最近一年使用:0次
2022-06-30更新
|
391次组卷
|
3卷引用:河北省沧州市2021-2022学年高二下学期期末考试化学试题
解题方法
6 . 过渡金属在生产、生活、科技等方面有着广泛的应用。例如仿生簇化合物Mn4XO4(X=Ca2+/Y3+/Gd3+)有望为实现利用太阳能和水获取清洁能源(氢能)开辟新途径,MnOx·Na2WO4·SiO2、钴(Co)的合金及其化合物材料等广泛应用于化工催化剂等领域。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为_______ 。
(2)基态Co原子核外有_______ 种运动状态不同的电子,其3d能级上有_______ 对成对电子。
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是_______ (填元素符号)。已知:[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-。[Co(CN)6]4-中含有σ键与π键的数目之比为_______ ,[Co(CN)6]3-中C的杂化方式为_______ 。
(4)[Mn(NH3)2]2+中配体分子的立体构型是_______ 。[Mn(NH3)2]2+中键角∠HNH_______ (填“大于” 、“小于”或“等于”)NH3中键角∠HNH。
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是_______ 。
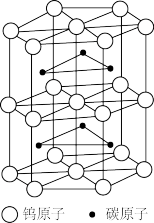
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是_______ ;已知:碳化钨晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,六棱柱高为a cm,则底边长为_______ (用含ρ、a、N的表达式表示)nm。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为
(2)基态Co原子核外有
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是
(4)[Mn(NH3)2]2+中配体分子的立体构型是
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是

您最近一年使用:0次
2022-05-27更新
|
409次组卷
|
5卷引用:河北省秦皇岛市2022届高三三模化学试题
河北省秦皇岛市2022届高三三模化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编河南省2022届高三下学期仿真模拟大联考理科综合化学试题(已下线)新疆博乐高级中学2022届高三第一次诊断性测试理科综合化学试卷广东省部分学校2022届高三下学期高考冲刺化学试题
名校
解题方法
7 . 氧族元素是元素周期表中第VIA族元素,包含氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)五种元素,它们及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为____ 。
(2)H2O、H2S、H2Se、H2Te的沸点由高到低的顺序为____ ,原因是____ 。
(3)SO 与SO
与SO 相比,键角较小的是
相比,键角较小的是___ (填离子符号),原因是____ 。
(4)依布硒是一种有机硒化物,具有良好的抗炎活性,其结构简式为 。依布硒分子中
。依布硒分子中 、C原子的杂化类型分别为
、C原子的杂化类型分别为____ 、____ 。
(5)国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)“发电玻璃”被誉为“挂在墙上的油田”。碲化镉立方晶胞结构如图。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知晶胞中A、B原子的分数坐标分别为A(0,0,0)、B( ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为____ 。
②碲化镉晶体的密度为ρg•cm-3,设NA为阿伏加德罗常数的值,则其晶胞边长为a=____ 。
(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为(2)H2O、H2S、H2Se、H2Te的沸点由高到低的顺序为
(3)SO
 与SO
与SO 相比,键角较小的是
相比,键角较小的是(4)依布硒是一种有机硒化物,具有良好的抗炎活性,其结构简式为
 。依布硒分子中
。依布硒分子中 、C原子的杂化类型分别为
、C原子的杂化类型分别为(5)国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)“发电玻璃”被誉为“挂在墙上的油田”。碲化镉立方晶胞结构如图。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知晶胞中A、B原子的分数坐标分别为A(0,0,0)、B(
 ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为②碲化镉晶体的密度为ρg•cm-3,设NA为阿伏加德罗常数的值,则其晶胞边长为a=
您最近一年使用:0次
2022-05-26更新
|
361次组卷
|
4卷引用:河北省沧衡八校联盟2021-2022学年高二下学期期中考试化学试题
河北省沧衡八校联盟2021-2022学年高二下学期期中考试化学试题河北省沧州市任丘第一中学2021-2022学年高二下学期阶段考试(二)化学试题四川省雅安中学2022-2023学年高二上学期期中考试化学试题(已下线)期中模拟预测卷03(测试范围:选择性必修2+选择性必修3第1-2章)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)
名校
解题方法
8 . “空气变馒头不是梦”,中国科学家在国际上首次实现了 到淀粉的从头合成,不依赖植物光合作用,原料只需
到淀粉的从头合成,不依赖植物光合作用,原料只需 、
、 和电,相关成果发表在《科学》上。请回答下列问题:
和电,相关成果发表在《科学》上。请回答下列问题:
(1) 的空间构型为
的空间构型为_______ ,其中C原子的杂化方式为_______ 。基态氧原子的最外层的成单电子和成对电子之比为_______ 。
(2)试推测
_______ (填“能”或“不能”)溶于 ,理由是
,理由是_______ 。
(3)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是_______ (用离子方程式表示)。
(4)淀粉在一定条件下可水解成葡萄糖( ),葡萄糖分子中键角
),葡萄糖分子中键角
_______ 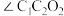 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(5)干冰的晶胞结构如下图所示,1个 分子周围与其距离相等且最近的
分子周围与其距离相等且最近的 分子个数为
分子个数为_______ 。若干冰晶胞沿x轴投影,试在图中画出 的投影位置(用“·”表示
的投影位置(用“·”表示 分子)。
分子)。_______
 到淀粉的从头合成,不依赖植物光合作用,原料只需
到淀粉的从头合成,不依赖植物光合作用,原料只需 、
、 和电,相关成果发表在《科学》上。请回答下列问题:
和电,相关成果发表在《科学》上。请回答下列问题:(1)
 的空间构型为
的空间构型为(2)试推测

 ,理由是
,理由是(3)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是
(4)淀粉在一定条件下可水解成葡萄糖(
 ),葡萄糖分子中键角
),葡萄糖分子中键角
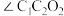 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(5)干冰的晶胞结构如下图所示,1个
 分子周围与其距离相等且最近的
分子周围与其距离相等且最近的 分子个数为
分子个数为 的投影位置(用“·”表示
的投影位置(用“·”表示 分子)。
分子)。
您最近一年使用:0次
2022-05-21更新
|
353次组卷
|
3卷引用:河北省唐山市2022届高三第三次模拟考试化学试题
河北省唐山市2022届高三第三次模拟考试化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编江西省南昌市第十九中学2022-2023学年高二下学期3月第一次月考化学试卷
解题方法
9 . 足球烯(C60)、线型碳是单质碳的同素异形体。回答下列问题:
(1)基态碳原子中,核外电子占据的最高能级是_______ 。碳可与钛形成碳化物,基态Ti2+的核外电子排布式是_______ 。
(2)线型碳有两种不同的键联结构,一种为 ,称为α-线型碳;另一种为
,称为α-线型碳;另一种为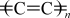 ,称为β-线型碳。β-线型碳中碳原子的杂化方式为
,称为β-线型碳。β-线型碳中碳原子的杂化方式为_______ 。常见C-C键的键长为0.154nm,α-线型碳中C-C键的键长为0.1378nm,原因是_______ 。
(3)一种C60晶体为面心立方结构,K+占据C60组成的四面体空隙和八面体空隙形成化合物K3C60的结构如图所示。A原子的分数坐标为(0,0,0),C原子的分数坐标为( ,
, ,
, ),若B原子的分数坐标为(0,0,0),则C原子的分数坐标为
),若B原子的分数坐标为(0,0,0),则C原子的分数坐标为_______ 。晶胞边长为anm,则K+与C60间的最短距离为_______ nm。敲除八面体空隙中的K+后晶体的密度为_______ g·cm-3(设NA为阿伏加德罗常数的值,用含有a和NA的计算式表示)。

(1)基态碳原子中,核外电子占据的最高能级是
(2)线型碳有两种不同的键联结构,一种为
 ,称为α-线型碳;另一种为
,称为α-线型碳;另一种为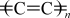 ,称为β-线型碳。β-线型碳中碳原子的杂化方式为
,称为β-线型碳。β-线型碳中碳原子的杂化方式为(3)一种C60晶体为面心立方结构,K+占据C60组成的四面体空隙和八面体空隙形成化合物K3C60的结构如图所示。A原子的分数坐标为(0,0,0),C原子的分数坐标为(
 ,
, ,
, ),若B原子的分数坐标为(0,0,0),则C原子的分数坐标为
),若B原子的分数坐标为(0,0,0),则C原子的分数坐标为
您最近一年使用:0次
2022-04-01更新
|
497次组卷
|
2卷引用:河北省承德市部分高中2023-2024学年高三上学期12月期中考试化学试题
2022·四川南充·二模
名校
解题方法
10 . NH3与甲醛CH2O反应可以制备乌洛托品(六亚甲基四胺,分子结构为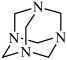 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
(1)基态氮原子的价电子轨道表达式为___________ ,第三电离能I3(C)___________ I3(N)(填“>”或“<)。
(2)NH3的空间构型为___________ ,CH2O中C采取的杂化类型为___________ 。CH2O中碳氢键与NH3中氮氢键相比,键长较长的是___________ 。
(3)乌洛托品为___________ (填“极性”或“非极性”)分子,分子中的所有N原子呈正四面体分布,所有C原子呈___________ 几何体分布,该分子可与H+形成配位键,电子对给予体为___________ 原子。
(4)在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为___________ 。乌洛托品比金刚烷(C10H16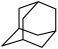 )水溶性更高,理由是
)水溶性更高,理由是___________ 。
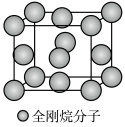
(5)金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3,阿伏加德罗常数为L×1023mol-1,则晶体的密度为___________ g/cm3。
 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:(1)基态氮原子的价电子轨道表达式为
(2)NH3的空间构型为
(3)乌洛托品为
(4)在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为
 )水溶性更高,理由是
)水溶性更高,理由是(5)金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3,阿伏加德罗常数为L×1023mol-1,则晶体的密度为

您最近一年使用:0次
2022-03-27更新
|
617次组卷
|
5卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)(结构与性质)
(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(结构与性质)四川省南充市2022届高三 适应性考试(二模)理综化学试题贵州省贵阳市五校2021-2022学年高三下学期联考理科综合化学试题(七)湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题



