名校
解题方法
1 . 物质的结构决定其性质,下列实例与解释不 相符的是
| 选项 | 实例 | 解释 |
| A | 邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点 | 分子间氢键使熔沸点升高,分子内氢键使熔沸点降低 |
| B |  与 与 形成配合物 形成配合物 |  中的 中的 有空轨道,可接受 有空轨道,可接受 中 中 的孤电子对 的孤电子对 |
| C |  的沸点高于 的沸点高于 |  原子半径小, 原子半径小, 键能大 键能大 |
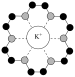
| D | 超分子冠醚(18-冠-6)如图所示,其空穴与 尺寸适配 尺寸适配
| 两者能通过弱相互作用(非化学键)形成超分子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
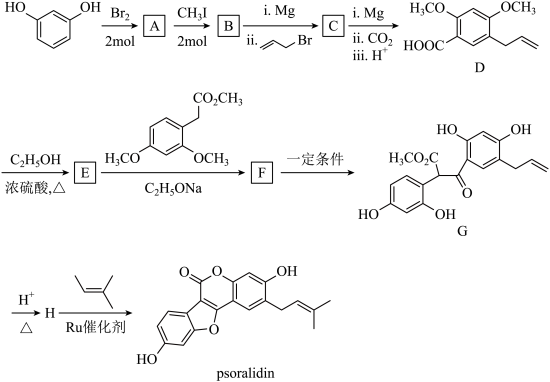
2 . 已知间苯二酚可以合成中草药的活性成分Psoralidin(化合物P),合成路线如下: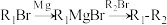 ;
;
ⅱ.
(1)A中含氧官能团的名称为_______ 。
(2)C的结构简式为_______ 。
(3)D→E的方程式为_______ 。
(4)下列关于物质F的说法正确的是_______。
(5)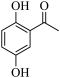 的同分异构体中,既能水解,又能发生银镜反应,还能使FeCl3溶液显紫色的有
的同分异构体中,既能水解,又能发生银镜反应,还能使FeCl3溶液显紫色的有_______ 种。
(6)H+ →P+J的反应原理如下。J的名称为
→P+J的反应原理如下。J的名称为_______ 。_______ 、_______ 、_______ 。
 ;
;ⅱ.

(1)A中含氧官能团的名称为
(2)C的结构简式为
(3)D→E的方程式为
(4)下列关于物质F的说法正确的是_______。
| A.分子中有1个手性碳原子 | B.存在顺反异构体 |
| C.碳原子的杂化方式有2种 | D.1molF最多能与7molH2发生加成反应 |
(5)
 的同分异构体中,既能水解,又能发生银镜反应,还能使FeCl3溶液显紫色的有
的同分异构体中,既能水解,又能发生银镜反应,还能使FeCl3溶液显紫色的有(6)H+
 →P+J的反应原理如下。J的名称为
→P+J的反应原理如下。J的名称为
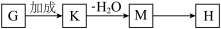
您最近一年使用:0次
2024-02-26更新
|
1072次组卷
|
5卷引用:大题预测卷(江西专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
(已下线)大题预测卷(江西专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)北京师范大学附属实验中学2023-2024学年高三下学期开学考化学试题辽宁省沈阳市东北育才学校2023-2024学年高三下学期第六次模拟考试化学试卷辽宁省沈阳市东北育才学校2023-2024学年高三下学期第六次模拟考试化学试卷(已下线)大题03 有机推断与合成综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
名校
解题方法
3 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物基础。“天宮”空间站使用的材料中含有B、C、N、P、Ni、Sb等元素,回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________ (填标号,下同),用光谱仪可捕捉到发射光谱的是___________ 。
A. B.
B.
C. D.
D.
(2)基态磷原子中自旋方向相反的电子数目相差___________ 个。
(3) 的熔沸点比
的熔沸点比 的熔沸点高的原因为
的熔沸点高的原因为___________ 。
(4)氟锑酸化学式为 ,酸性比纯硫酸强
,酸性比纯硫酸强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成 ,则其阳离子的空间结构为
,则其阳离子的空间结构为___________ ,阴离子中心原子的杂化方式应该是___________ (填序号)。
A. B.
B. C.
C. D.
D.
(5)由铁原子核形成的四种微粒,价电子排布图分别为:① 、②
、② 、③
、③ 、④
、④ ,有关这些微粒的叙述,正确的是
,有关这些微粒的叙述,正确的是___________ 。
A.微粒半径:①>②>③
B.得电子能力:②>①>③
C.微粒③价电子在简并轨道中单独分占,且自旋相同,故不能再继续失去电子
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B.
C.
 D.
D.
(2)基态磷原子中自旋方向相反的电子数目相差
(3)
 的熔沸点比
的熔沸点比 的熔沸点高的原因为
的熔沸点高的原因为(4)氟锑酸化学式为
 ,酸性比纯硫酸强
,酸性比纯硫酸强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成 ,则其阳离子的空间结构为
,则其阳离子的空间结构为A.
 B.
B. C.
C. D.
D.
(5)由铁原子核形成的四种微粒,价电子排布图分别为:①
 、②
、② 、③
、③ 、④
、④ ,有关这些微粒的叙述,正确的是
,有关这些微粒的叙述,正确的是A.微粒半径:①>②>③
B.得电子能力:②>①>③
C.微粒③价电子在简并轨道中单独分占,且自旋相同,故不能再继续失去电子
您最近一年使用:0次
4 . 低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)用 催化加氢可以制取乙烯。
催化加氢可以制取乙烯。 ,该反应体系的能量随反应过程变化关系如图所示,则该反应的
,该反应体系的能量随反应过程变化关系如图所示,则该反应的
_______  (用含a、b的式子表示)。
(用含a、b的式子表示)。

(2)工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:


则
_______  。
。
(3)在 完全燃烧生成
完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有 生成时,放出
生成时,放出 的热量,写出
的热量,写出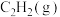 燃烧热的热化学方程式
燃烧热的热化学方程式_______ ;
(4)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由 制取C的太阳能工艺如图:
制取C的太阳能工艺如图:

①已知“重整系统”发生的反应中 ,则
,则 的化学式为
的化学式为_______ ,“热分解系统”中每转移 电子,需消耗
电子,需消耗
_______ mol。
(5)18-冠-6是冠醚的一种,是有机合成中重要的相转移催化剂,其结构如图A所示,回答下列问题:

18-冠-6中碳原子核外电子有_______ 种不同的空间运动状态,氧原子的杂化类型为_______ 。
(1)用
 催化加氢可以制取乙烯。
催化加氢可以制取乙烯。 ,该反应体系的能量随反应过程变化关系如图所示,则该反应的
,该反应体系的能量随反应过程变化关系如图所示,则该反应的
 (用含a、b的式子表示)。
(用含a、b的式子表示)。
(2)工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:

则

 。
。(3)在
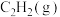 完全燃烧生成
完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有 生成时,放出
生成时,放出 的热量,写出
的热量,写出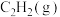 燃烧热的热化学方程式
燃烧热的热化学方程式(4)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由
 制取C的太阳能工艺如图:
制取C的太阳能工艺如图:
①已知“重整系统”发生的反应中
 ,则
,则 的化学式为
的化学式为 电子,需消耗
电子,需消耗
(5)18-冠-6是冠醚的一种,是有机合成中重要的相转移催化剂,其结构如图A所示,回答下列问题:

18-冠-6中碳原子核外电子有
您最近一年使用:0次
名校
解题方法
5 . 硅元素广泛应用于半导体、光伏、塑料工业。回答下列问题:
(1)同周期元素中,成对电子数比硅多的元素有___________ 种。
(2)晶体硅和碳化硅的熔点相比,较高的是________ (填化学式),原因是_______ 。
(3)由于硅的价层有d轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物 (平面形)和
(平面形)和 中,更易形成配合物的是
中,更易形成配合物的是_______ (填化学式);下列划线原子与 中N原子杂化类型相同的是
中N原子杂化类型相同的是_________ (填序号)。
A.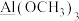 B.
B. C.
C.
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为120°,z方向垂直于x、y方向,底面棱长均为a ,侧面棱长为c
,侧面棱长为c ),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。
),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。

① 原子构成正四面体,则A原子的分数坐标为
原子构成正四面体,则A原子的分数坐标为___________ 。
②该新型材料的化学式为___________ ,已知该新型材料的摩尔质量为M ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则密度为
表示,则密度为___________  (用含a、c、M、
(用含a、c、M、 的计算式表示)。
的计算式表示)。
(1)同周期元素中,成对电子数比硅多的元素有
(2)晶体硅和碳化硅的熔点相比,较高的是
(3)由于硅的价层有d轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物
 (平面形)和
(平面形)和 中,更易形成配合物的是
中,更易形成配合物的是 中N原子杂化类型相同的是
中N原子杂化类型相同的是A.
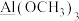 B.
B. C.
C.
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为120°,z方向垂直于x、y方向,底面棱长均为a
 ,侧面棱长为c
,侧面棱长为c ),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。
),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。
①
 原子构成正四面体,则A原子的分数坐标为
原子构成正四面体,则A原子的分数坐标为②该新型材料的化学式为
 ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则密度为
表示,则密度为 (用含a、c、M、
(用含a、c、M、 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
名校
解题方法
6 . C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外最外层电子排布式_____ ,C、O、Si三种元素的电负性由大到小的顺序为_____ 。
(2)SiC晶体的结构与晶体硅的相似,其中C原子的杂化方式为_____ 。
(3)氧化物XO的电子总数与SiC的相等,则X为_____ (填元素符号),XO是优良的耐高温材料,其熔点比CaO高的原因是_____ 。
(4)向盛有硫酸铜水溶液的试管中加氨水,先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,用化学方程式说明沉淀溶解的原因:_____ 。
(5)下图表示的是SiO2的晶胞结构(白圈代表硅原子,黑点代表氧原子),判断在30g二氧化硅晶体中含_____ 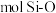 键;如果该立方体的边长为
键;如果该立方体的边长为 ,用
,用 表示阿伏加德罗常数,则SiO2晶体的密度表达式为
表示阿伏加德罗常数,则SiO2晶体的密度表达式为_____  。
。

(1)写出Si的基态原子核外最外层电子排布式
(2)SiC晶体的结构与晶体硅的相似,其中C原子的杂化方式为
(3)氧化物XO的电子总数与SiC的相等,则X为
(4)向盛有硫酸铜水溶液的试管中加氨水,先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,用化学方程式说明沉淀溶解的原因:
(5)下图表示的是SiO2的晶胞结构(白圈代表硅原子,黑点代表氧原子),判断在30g二氧化硅晶体中含
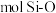 键;如果该立方体的边长为
键;如果该立方体的边长为 ,用
,用 表示阿伏加德罗常数,则SiO2晶体的密度表达式为
表示阿伏加德罗常数,则SiO2晶体的密度表达式为 。
。
您最近一年使用:0次
7 . 三元锂电池性能优异、能量密度高,正极材料包含了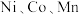 三种过渡金属氧化物。
三种过渡金属氧化物。
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为___________ 。
(2)在稀氨水介质中, 与丁二酮肟(分子式为
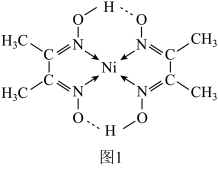
与丁二酮肟(分子式为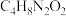 )反应可生成鲜红色沉淀,其分子结构如图1所示,该结构中碳原子的杂化方式为
)反应可生成鲜红色沉淀,其分子结构如图1所示,该结构中碳原子的杂化方式为___________ 。
(3) 易与氨水反应生成的
易与氨水反应生成的 ,
, 配位数为
配位数为___________ , 形成配合物后
形成配合物后 键角会
键角会___________ (填“变大”、“变小”或“不变”),原因是___________ 。
(4)下表是 与
与 的部分电离能数据,解释
的部分电离能数据,解释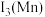 大于
大于 的主要原因:
的主要原因:___________ 。
(5) 与
与 类似,其晶体堆积方式为六方最密堆积,其晶胞结构如图所示,则该晶胞中含有的原子个数为
类似,其晶体堆积方式为六方最密堆积,其晶胞结构如图所示,则该晶胞中含有的原子个数为___________ ,已知该晶胞的底边长为 ,高为
,高为 ,则晶胞密度为
,则晶胞密度为___________  。
。

 三种过渡金属氧化物。
三种过渡金属氧化物。(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为(2)在稀氨水介质中,
 与丁二酮肟(分子式为
与丁二酮肟(分子式为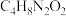 )反应可生成鲜红色沉淀,其分子结构如图1所示,该结构中碳原子的杂化方式为
)反应可生成鲜红色沉淀,其分子结构如图1所示,该结构中碳原子的杂化方式为
(3)
 易与氨水反应生成的
易与氨水反应生成的 ,
, 配位数为
配位数为 形成配合物后
形成配合物后 键角会
键角会(4)下表是
 与
与 的部分电离能数据,解释
的部分电离能数据,解释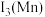 大于
大于 的主要原因:
的主要原因:| 元素 |  |  |
第二电离能 ( (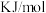 ) ) | 1561 | 1509 |
第三电离能 ( (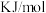 ) ) | 2957 | 3248 |
 与
与 类似,其晶体堆积方式为六方最密堆积,其晶胞结构如图所示,则该晶胞中含有的原子个数为
类似,其晶体堆积方式为六方最密堆积,其晶胞结构如图所示,则该晶胞中含有的原子个数为 ,高为
,高为 ,则晶胞密度为
,则晶胞密度为 。
。
您最近一年使用:0次
解题方法
8 . 镍的合金及其配合物用途非常广泛。回答下列问题:
(1)基态Ni原子的价电子排布式为___________ , 最高能级电子云轮廓图为___________ 形。
(2)Ni与Ca均位于第四周期,最外层电子数也相同,但Ni的熔点和沸点均比Ca的高,这是因为___________ 。
(3)镍可形成Ni(NH3)4(NCS)2、Ni(NH3)4 (NO2)2、K2[NiF4]等多种配合物。
①配体NCS-中,三种元素的电负性最大的是___________ 。
②配体 的空间构型为
的空间构型为___________ 形,中心原子的杂化方式是___________ 。
③K2[NiF4 ]可由反应NiF2 + 2KHF2=K2[NiF4]+2HF制取,KHF2晶体中所含的化学键类型有___________ (填字母)。
A.离子键 B.σ键 C.π键 D.非极性键
(4)Ni2 MnGa晶体的立方晶胞结构如图a所示。

①已知Ni2MnGa的晶胞参数为0.5822nm,设NA为阿伏加德罗常数的数值,则Ni2MnGa晶体的密度为___________ (列出计算式)g· cm-3。
②Ni2MnGa晶体的晶胞结构还可以用图b表示,若●表示的是Mn,则 表示的是
表示的是___________ ,⊕表示的是___________ 。

(1)基态Ni原子的价电子排布式为
(2)Ni与Ca均位于第四周期,最外层电子数也相同,但Ni的熔点和沸点均比Ca的高,这是因为
(3)镍可形成Ni(NH3)4(NCS)2、Ni(NH3)4 (NO2)2、K2[NiF4]等多种配合物。
①配体NCS-中,三种元素的电负性最大的是
②配体
 的空间构型为
的空间构型为③K2[NiF4 ]可由反应NiF2 + 2KHF2=K2[NiF4]+2HF制取,KHF2晶体中所含的化学键类型有
A.离子键 B.σ键 C.π键 D.非极性键
(4)Ni2 MnGa晶体的立方晶胞结构如图a所示。

①已知Ni2MnGa的晶胞参数为0.5822nm,设NA为阿伏加德罗常数的数值,则Ni2MnGa晶体的密度为
②Ni2MnGa晶体的晶胞结构还可以用图b表示,若●表示的是Mn,则
 表示的是
表示的是
您最近一年使用:0次
名校
解题方法
9 . 短周期主族元素X、Y、Z、G、T的原子序数依次增大,Z、G是金属元素且G的氧化物属于两性氧化物,T的原子序数是Y的2倍且T、Y的最低化合价相同。这5种元素的价电子数之和等于20,含Z元素的物质的焰色呈黄色。回答下列问题:
(1)X的最高价氧化物对应水化物的化学式为___________ 。位于元素周期表中s区的元素为___________ (填元素符号)。
(2)Y、Z、G、T的电负性由小到大的顺序为___________ (填元素符号)。
(3) 分子是
分子是___________ (填“极性”或“非极性”)分子。 分子中T的价层电子对数为
分子中T的价层电子对数为___________ 。
(4)Y和Z能形成既含离子键,又含共价键的化合物,其化学式为___________ 。
(5)V是由Y、Z、T组成的化合物,V的水溶液呈中性。则V的阴离子的空间构型___________ 。
(6)T的一种单质的结构如图所示: ,T原子杂化类型是
,T原子杂化类型是________ 。32gT的这种单质含σ键的数目为________ 。这种单质易溶于 ,不溶于水,其原因是
,不溶于水,其原因是_________ 。
(1)X的最高价氧化物对应水化物的化学式为
(2)Y、Z、G、T的电负性由小到大的顺序为
(3)
 分子是
分子是 分子中T的价层电子对数为
分子中T的价层电子对数为(4)Y和Z能形成既含离子键,又含共价键的化合物,其化学式为
(5)V是由Y、Z、T组成的化合物,V的水溶液呈中性。则V的阴离子的空间构型
(6)T的一种单质的结构如图所示:
 ,T原子杂化类型是
,T原子杂化类型是 ,不溶于水,其原因是
,不溶于水,其原因是
您最近一年使用:0次
2023-04-28更新
|
180次组卷
|
3卷引用:江西省南昌市等5地2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
10 . 铜及其化合物在生产、生活中有广泛应用。最近科学家开发出石墨炔调控Cu单原子电催化剂 实现
实现 还原制备
还原制备 ,反应为
,反应为 。
。
(1)铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的波长,则绿色对应的波长为___________ (填标号)。
A.577~492nm B.597~577nm C.622~597nm
基态Cu原子的未成对电子占据原子轨道的形状为___________ 。
(2)①上述反应涉及的物质中,既含 键又含
键又含 键的非极性分子是
键的非极性分子是___________ (填分子式)。
②VSEPR模型和空间结构相同的分子有___________ (填分子式)。
③在周期表中铜和锌相邻,第二电离能与第一电离能相差较大的是___________ (填元素符号)。
(3)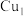 催化剂如图所示。铜的配位数为
催化剂如图所示。铜的配位数为___________ 。N原子与直接连接的原子构成的空间结构是___________ 。

(4)铜可形成多种配合物,如 、
、 等。
等。 分子中
分子中 键角为107°,在
键角为107°,在 中的
中的 键角为109.5°,键角变大的原因是
键角为109.5°,键角变大的原因是___________ 。
(5)最近我国科学家开发出一种高效储存、分离、提纯 新材料,晶胞结构如图所示。已知:图(a)边长为xpm,图(c)中高为ypm,Ca、Cu的原子半径分别为
新材料,晶胞结构如图所示。已知:图(a)边长为xpm,图(c)中高为ypm,Ca、Cu的原子半径分别为 、
、 ,设
,设 为阿伏加德罗常数的值。该晶胞中原子空间利用率为
为阿伏加德罗常数的值。该晶胞中原子空间利用率为___________ (注:晶胞中原子空间利用率等于原子总体积与晶胞体积之比)。

 实现
实现 还原制备
还原制备 ,反应为
,反应为 。
。(1)铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的波长,则绿色对应的波长为
A.577~492nm B.597~577nm C.622~597nm
基态Cu原子的未成对电子占据原子轨道的形状为
(2)①上述反应涉及的物质中,既含
 键又含
键又含 键的非极性分子是
键的非极性分子是②VSEPR模型和空间结构相同的分子有
③在周期表中铜和锌相邻,第二电离能与第一电离能相差较大的是
(3)
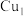 催化剂如图所示。铜的配位数为
催化剂如图所示。铜的配位数为
(4)铜可形成多种配合物,如
 、
、 等。
等。 分子中
分子中 键角为107°,在
键角为107°,在 中的
中的 键角为109.5°,键角变大的原因是
键角为109.5°,键角变大的原因是(5)最近我国科学家开发出一种高效储存、分离、提纯
 新材料,晶胞结构如图所示。已知:图(a)边长为xpm,图(c)中高为ypm,Ca、Cu的原子半径分别为
新材料,晶胞结构如图所示。已知:图(a)边长为xpm,图(c)中高为ypm,Ca、Cu的原子半径分别为 、
、 ,设
,设 为阿伏加德罗常数的值。该晶胞中原子空间利用率为
为阿伏加德罗常数的值。该晶胞中原子空间利用率为
您最近一年使用:0次
2023-04-09更新
|
355次组卷
|
3卷引用:江西省赣州市第四中学2022-2023学年高二下学期5月期中化学试题
江西省赣州市第四中学2022-2023学年高二下学期5月期中化学试题山东省聊城市部分学校2022-2023学年高三下学期第三次学业质量联合检测化学试题(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)