1 . 回答下列问题:
(1)符号“3px”没有给出的信息是_______。
(2)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布不可能是_______。
(3)X元素的原子最外层电子排布式为(n+1)sn(n+1)pn+1,则X的氢化物的化学式是_______。
(4)下列比较正确的是_______。
(5)下列实验事实不能用氢键来解释的是_______。
(6)由磷原子核形成的三种微粒:a.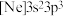 、b.
、b. 、c.
、c. ,半径由大到小的顺序为
,半径由大到小的顺序为_______ (填标号,下同);再失去一个电子所需最低能量由大到小的顺序为_______ 。
(7)比较H-O-H键角大小;H3O+_______ H2O(填“>”、“<”或“=”)。
(8)胍(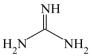 )分子中碳原子和氮原子共平面,胍中N杂化方式为
)分子中碳原子和氮原子共平面,胍中N杂化方式为_______ 。
(1)符号“3px”没有给出的信息是_______。
| A.能层 | B.能级 | C.电子云在空间的伸展方向 | D.电子的自旋方向 |
(2)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布不可能是_______。
| A.4s1 | B.3p64s1 | C.3d54s1 | D.3d104s1 |
(3)X元素的原子最外层电子排布式为(n+1)sn(n+1)pn+1,则X的氢化物的化学式是_______。
| A.HX | B.H2X | C.XH3 | D.XH4 |
(4)下列比较正确的是_______。
| A.酸性:H3PO4<H3AsO4 | B.熔点:MgO>CaO |
| C.离子半径:r(Al3+)>r(O2-) | D.键角:H2O>NH3 |
(5)下列实验事实不能用氢键来解释的是_______。
| A.CH4比SiH4稳定 |
| B.乙醇能与水以任意比互溶 |
| C.邻羟基苯甲醛的沸点低于对羟基苯甲醛 |
| D.接近沸点的水蒸气的相对分子质量测量值大于18 |
(6)由磷原子核形成的三种微粒:a.
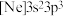 、b.
、b. 、c.
、c. ,半径由大到小的顺序为
,半径由大到小的顺序为(7)比较H-O-H键角大小;H3O+
(8)胍(
 )分子中碳原子和氮原子共平面,胍中N杂化方式为
)分子中碳原子和氮原子共平面,胍中N杂化方式为
您最近一年使用:0次
2 . 扎染是我国重要的非物质文化遗产,扎染用到的靛蓝已具有三千多年历史,战国时期荀况的“青,出于蓝而胜于蓝”就源于当时的染蓝技术。染色时发生以下反应,有关说法正确的是
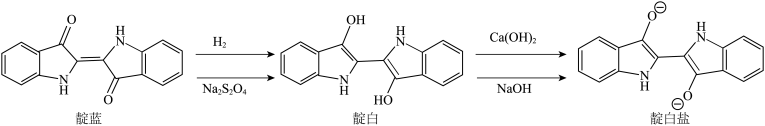
| A.靛蓝耐碱、耐酸、耐氧化 |
| B.由靛白与碱反应生成靛白盐的反应可推知,靛白中的五元环有着类似于苯环的性质 |
C.靛蓝分子中存在由p轨道“头碰头”形成的 键 键 |
D.已知靛白中N原子是 杂化,靛白分子中存在 杂化,靛白分子中存在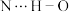 氢键 氢键 |
您最近一年使用:0次
名校
解题方法
3 . 以CO2为原料催化加氢可以制备CH4、CH3OH、C2H4,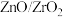 为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:
为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:
(1)基态 原子电子排布式为
原子电子排布式为___________ ,其核外不同能量状态的电子有___________ 种。
(2)CO 中的大
中的大 键可表示为
键可表示为___________ ,同一周期第一电离能大趋势在逐渐增大,但是存在反常,比如 ,请解释原因:
,请解释原因:___________ 。
(3) 催化加氢制备
催化加氢制备 的化学方程式为CO2+3H2=CH3OH+H2O。
的化学方程式为CO2+3H2=CH3OH+H2O。
①等物质的量的CH3OH和CO2分子中 键数目之比为
键数目之比为___________ 。
②沸点:CH3OH___________ (填“>”或“<”)CH4,其原因为___________ 。
(4)四方体 晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置,
晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置, 、
、 、
、 原子的坐标参数分别为(0,0,0)、(
原子的坐标参数分别为(0,0,0)、( ,0,
,0, )、(
)、( ,
, ,
, )。
)。___________ ,配位数为___________ 。
②假设ZrO2的密度为 ,摩尔质量为
,摩尔质量为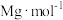 ,
, 表示阿伏加德罗常数的值,则晶胞中Zr和O原子的最短距离为
表示阿伏加德罗常数的值,则晶胞中Zr和O原子的最短距离为___________  (列出算式即可)。
(列出算式即可)。
③将该晶体沿体对角线的方向投影如下图所示,请将O2-涂黑___________ 。
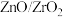 为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:
为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:(1)基态
 原子电子排布式为
原子电子排布式为(2)CO
 中的大
中的大 键可表示为
键可表示为 ,请解释原因:
,请解释原因:(3)
 催化加氢制备
催化加氢制备 的化学方程式为CO2+3H2=CH3OH+H2O。
的化学方程式为CO2+3H2=CH3OH+H2O。①等物质的量的CH3OH和CO2分子中
 键数目之比为
键数目之比为②沸点:CH3OH
(4)四方体
 晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置,
晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置, 、
、 、
、 原子的坐标参数分别为(0,0,0)、(
原子的坐标参数分别为(0,0,0)、( ,0,
,0, )、(
)、( ,
, ,
, )。
)。
②假设ZrO2的密度为
 ,摩尔质量为
,摩尔质量为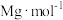 ,
, 表示阿伏加德罗常数的值,则晶胞中Zr和O原子的最短距离为
表示阿伏加德罗常数的值,则晶胞中Zr和O原子的最短距离为 (列出算式即可)。
(列出算式即可)。③将该晶体沿体对角线的方向投影如下图所示,请将O2-涂黑

您最近一年使用:0次
解题方法
4 . 镍铜合金由 镍、
镍、 铜、
铜、 铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,可作为航空发动机的结构材料。
铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,可作为航空发动机的结构材料。
(1)铁元素在元素周期表中的位置为___________ ,基态镍原子的价电子排布式为___________ 。
(2)已知NiO、FeO属于离子晶体,则熔点NiO___________ FeO(填“<”或“>”),原因是___________ 。
(3)Cu与Fe的第二电离能较大的是___________ ,主要原因是___________ 。
(4) 可与
可与 甲基咪唑(
甲基咪唑( )形成配合物。
)形成配合物。 甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
①4-甲基咪唑中,C原子的杂化轨道类型有___________
②4-甲基咪唑中,___________ (填“1”或“3”)号N原子更容易与Cu+形成配位键。
(5)已知Cu2O的立方晶胞结构如图所示。
①已知a、b的分数坐标依次为 ,则d的分数坐标为
,则d的分数坐标为___________
②已知Cu2O晶体的密度为 ,是阿伏加德罗常数的值,则该晶胞的晶胞参数n为
,是阿伏加德罗常数的值,则该晶胞的晶胞参数n为___________ pm(用含ρ、NA的式子表示,不必化简)。
 镍、
镍、 铜、
铜、 铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,可作为航空发动机的结构材料。
铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,可作为航空发动机的结构材料。(1)铁元素在元素周期表中的位置为
(2)已知NiO、FeO属于离子晶体,则熔点NiO
(3)Cu与Fe的第二电离能较大的是
(4)
 可与
可与 甲基咪唑(
甲基咪唑( )形成配合物。
)形成配合物。 甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。①4-甲基咪唑中,C原子的杂化轨道类型有
②4-甲基咪唑中,
(5)已知Cu2O的立方晶胞结构如图所示。

①已知a、b的分数坐标依次为
 ,则d的分数坐标为
,则d的分数坐标为②已知Cu2O晶体的密度为
 ,是阿伏加德罗常数的值,则该晶胞的晶胞参数n为
,是阿伏加德罗常数的值,则该晶胞的晶胞参数n为
您最近一年使用:0次
名校
解题方法
5 . 硅在自然界中大量以硅的氧化物和硅酸盐形式存在,金刚砂(熔点2700℃)在工业上也有极大应用,晶体硅更是信息产业的核心与灵魂。面对中国芯的瓶颈,美团、百度、阿里、腾讯纷纷加入“造芯大军”,同时也加大在金属锰配合物领域的研究。
(1)下列有关硅及化合物的说法正确的是_______ 。

a.晶体硅中掺嵌硼使晶体整体缺电子(有空穴),可作光电池的正极
b.SiHCl3、SiH2Cl2、SiCl4均为正四面体构型
c.由金刚砂的晶体结构可知(见图),距离硅原子最近的硅原子数为12
d.晶体硅的熔点大于2700℃
(2)配位化合物[Mn(NH3)4(H2O)2]Cl3中元素Mn、N、O第一电离能由大到小的顺序为_______ ,配体NH3分子中氮原子的杂化类型为_______ ,1mol该配合物中含有的σ键数目为_______ 。
(3)[Mn(NH3)6]Cl3中配体分子NH3以及与其空间结构相似的AsH3分子。NH3的沸点比AsH3的_______ ,原因是_______ ,AsH3的键角小于NH3的,分析原因 _______ 。
(4)将金刚砂晶胞中的硅原子换成碳原子便构成金刚石晶胞,金刚石晶胞含有_______ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_______ a,列式表示碳原子在晶胞中的空间占有率_______ (用含π的表达式表示)。
(1)下列有关硅及化合物的说法正确的是

a.晶体硅中掺嵌硼使晶体整体缺电子(有空穴),可作光电池的正极
b.SiHCl3、SiH2Cl2、SiCl4均为正四面体构型
c.由金刚砂的晶体结构可知(见图),距离硅原子最近的硅原子数为12
d.晶体硅的熔点大于2700℃
(2)配位化合物[Mn(NH3)4(H2O)2]Cl3中元素Mn、N、O第一电离能由大到小的顺序为
(3)[Mn(NH3)6]Cl3中配体分子NH3以及与其空间结构相似的AsH3分子。NH3的沸点比AsH3的
(4)将金刚砂晶胞中的硅原子换成碳原子便构成金刚石晶胞,金刚石晶胞含有
您最近一年使用:0次
名校
解题方法
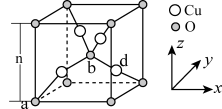
6 . 2022年春晚节目《只此青绿》取材于宋代名画《千里江山图》,该画描绘了山清水秀的美丽景色,历经千年色彩依然,其中青色来自蓝铜矿颜料[主要成分为Cu3(CO3)2(OH)2]。请回答下列问题:
(1)基态铜原子价电子排布式为_______ 。从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)_______ I2(Cu) (填“>”“<”或“=”),并解释有关原因_______ 。
(2) 的空间构型为
的空间构型为_______ 。
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是_______ (填元素符号),该配合物中采用sp2杂化的碳原子与sp3杂化的碳原子个数比为_______ 。
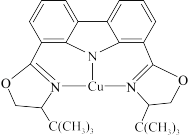
(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。
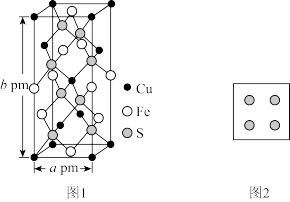
①Fe3+周围距离最近的S2-的个数为_______ 。
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为_______ mol-1(用a、b、ρ表示,并化成最简)。
(1)基态铜原子价电子排布式为
(2)
 的空间构型为
的空间构型为(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是

(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。

①Fe3+周围距离最近的S2-的个数为
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为
您最近一年使用:0次
2022-05-04更新
|
736次组卷
|
4卷引用:安徽省淮北市2022届高三第二次模拟考试理科综合化学试题
安徽省淮北市2022届高三第二次模拟考试理科综合化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)山东省菏泽市单县第二中学2021-2022学年高二下学期慧光班段考化学试题四川省南充高级中学2021-2022学年高二下学期期中考试化学试题
解题方法
7 . 镍锰酸锂(LiNi0.5Mn1.5O4)是一种成本低、原料丰富且环境友好的尖晶石结构材料,被认为是下一代动力锂离子电池首选的正极材料之一。回答下列问题:
(1)基态Mn原子的价电子层电子排布式为_______ 。
(2)Ni2+可与丁二酮肟反应生成如下物质:

①该物质中含有的化学键类型有_______ (填标号)。
A.共价键 B.离子键 C.配位键 D.金属键
②C、N、O的第一电离能由大到小的顺序是_______ 。
(3)[Ni(N2H4)2](N3)2是一种富氮含能材料,N2H4中氮原子的杂化方式为_______ ;写出一种与N 互为等电子体的分子
互为等电子体的分子_______ (填化学式);实验数据表明键角NH3>PH3>AsH3,分析原因是_______ 。
(4)氮与碳还能形成一种离子液体的正离子 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是_______ 。
(5)研究人员设计了新款Li3SBF4快离子导体,具有良好导电能力,为锂离子电池的发展做出了有益的贡献。晶胞图如下,其中BF 位于体心,则
位于体心,则 位于
位于_______ (填“顶点”或“棱心”)。若该晶胞最近的 与
与 距离为apm,则晶胞密度为
距离为apm,则晶胞密度为_______ g·cm-3(列出计算式)。

(1)基态Mn原子的价电子层电子排布式为
(2)Ni2+可与丁二酮肟反应生成如下物质:

①该物质中含有的化学键类型有
A.共价键 B.离子键 C.配位键 D.金属键
②C、N、O的第一电离能由大到小的顺序是
(3)[Ni(N2H4)2](N3)2是一种富氮含能材料,N2H4中氮原子的杂化方式为
 互为等电子体的分子
互为等电子体的分子(4)氮与碳还能形成一种离子液体的正离子
 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是(5)研究人员设计了新款Li3SBF4快离子导体,具有良好导电能力,为锂离子电池的发展做出了有益的贡献。晶胞图如下,其中BF
 位于体心,则
位于体心,则 位于
位于 与
与 距离为apm,则晶胞密度为
距离为apm,则晶胞密度为
您最近一年使用:0次
名校
解题方法
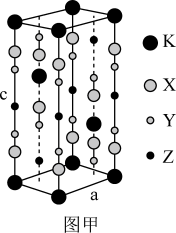
8 . 氟代硼铍酸钾晶体KBBF(KBe2BO3F2)是一种非线性光学晶体材料,广泛应用于激光、光刻录等领域,长方体晶胞如下图甲所示(其中K原子已经给出,氧原子略去)。回答下列问题:
(1)下列铍元素的不同微粒,若再失去一个电子需要能量最大的是 ___________。
(2)K2O2的阴阳离子比为___________ 。第四周期,与基态钾原子最外层电子数相同的原子有___________ (填元素符号)。
(3)OF2分子中氧原子的杂化类型是___________ ,空间构型为___________ 。
(4)KBBF所含元素中非金属元素的电负性由大到小的顺序是___________ 。
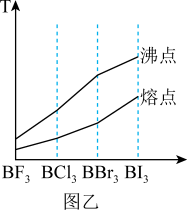
(5)三卤化硼的熔沸点如图乙所示,BF3、BCl3、BBr3、BI3的熔沸点变化的原因是___________ 。
(6)指出图甲中代表硼原子的字母为___________ ,该KBBF晶体的晶胞参数分别为apm和cpm,则晶体密度为___________ g·cm-3(M代表KBBF的摩尔质量,NA表示阿伏加德罗常数的值)。

(1)下列铍元素的不同微粒,若再失去一个电子需要能量最大的是 ___________。
A. | B.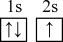 | C.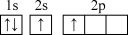 | D.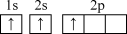 |
(3)OF2分子中氧原子的杂化类型是
(4)KBBF所含元素中非金属元素的电负性由大到小的顺序是
(5)三卤化硼的熔沸点如图乙所示,BF3、BCl3、BBr3、BI3的熔沸点变化的原因是

(6)指出图甲中代表硼原子的字母为
您最近一年使用:0次
2022-02-02更新
|
576次组卷
|
4卷引用:安徽省蚌埠市2021-2022学年高三上学期第二次教学质量检查理综化学试题
安徽省蚌埠市2021-2022学年高三上学期第二次教学质量检查理综化学试题(已下线)【直击双一流】05-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)河北省衡水中学2021-2022学年高三下学期二调考试化学试题
解题方法
9 . 根据元素在体内含量的不同,可将体内元素分为常量元素和微量元素。其中H、C、O、N、S、P等为常量元素,Fe、Zn、Se等为微量元素。回答下列问题:
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的Se原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的Se原子,其价电子自旋磁量子数的代数和为___________ 。
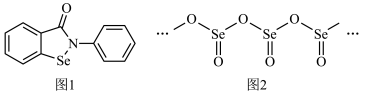
(2)“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图1所示。“依布硒”中Se原子的杂化类型为___________ ,元素Se、O、N的第一电离能由大到小的顺序为___________ 。
(3)硒的某种氧化物为链状聚合结构(如图2所示),该氧化物的化学式为___________ 。
(4)已知NaH2PO2是次磷酸的正盐,H3PO2的结构式为___________ 。
(5)过渡金属配合物Ni(CO)n的中心原子价电子数与CO提供配位的电子总数之和18,则n=___________ ;该化合物易溶于苯及四氯化碳等有机溶剂,原因是___________ 。
(6)某C、Fe合金的晶胞结构如图所示:
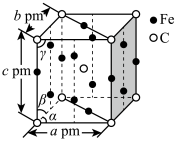
若该晶体的晶胞参数为a pm、b pm、c pm,α=β=γ=90o,密度为ρ g·cm-3,则NA为____ (写出计算式即可)。
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的Se原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的Se原子,其价电子自旋磁量子数的代数和为(2)“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图1所示。“依布硒”中Se原子的杂化类型为
(3)硒的某种氧化物为链状聚合结构(如图2所示),该氧化物的化学式为

(4)已知NaH2PO2是次磷酸的正盐,H3PO2的结构式为
(5)过渡金属配合物Ni(CO)n的中心原子价电子数与CO提供配位的电子总数之和18,则n=
(6)某C、Fe合金的晶胞结构如图所示:

若该晶体的晶胞参数为a pm、b pm、c pm,α=β=γ=90o,密度为ρ g·cm-3,则NA为
您最近一年使用:0次
名校
10 . 乙二胺在电刷镀铜溶液中能起到稳定剂的作用。回答下列问题。
(1)基态Cu原子最高能级组电子数为___________ 个。
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:
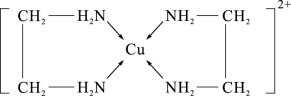
①配离子中含有的化学键类型有___________ 。
②C、N、O的第一电离能由大到小的顺序是___________ 。
③乙二胺分子中氮原子轨道的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因___________ ;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则___________ 是Na+最可能通过途径迁移到空位处(填图中序号)。
·
(4)某镍白铜合金的立方晶胞结构如图所示。
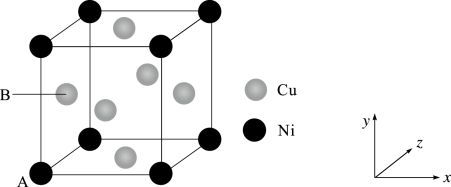
①原子A的原子坐标为(0,0,0),原子B的原子坐标为___________ 。
②若合金的密度为ρg/cm3,Ni原子之间最短距离为___________ nm(列出计算式)。
(1)基态Cu原子最高能级组电子数为
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:

①配离子中含有的化学键类型有
②C、N、O的第一电离能由大到小的顺序是
③乙二胺分子中氮原子轨道的杂化类型为
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因·

(4)某镍白铜合金的立方晶胞结构如图所示。

①原子A的原子坐标为(0,0,0),原子B的原子坐标为
②若合金的密度为ρg/cm3,Ni原子之间最短距离为
您最近一年使用:0次
2021-05-07更新
|
985次组卷
|
6卷引用:安徽省宿州市2021届高三下学期第三次模拟考试理综化学试题
安徽省宿州市2021届高三下学期第三次模拟考试理综化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题2021年山东高考化学试题变式题11-202022届江西省赣州市高三适应性考试(二模)理综化学试题



